07. Coagulazione e Flocculazione
07. Coagulazione e Flocculazione
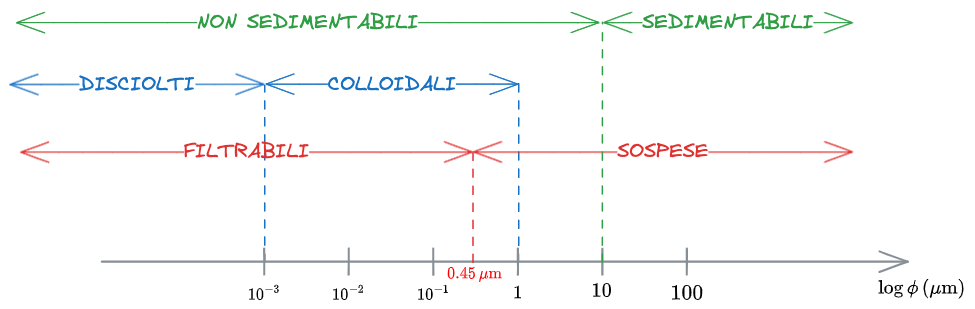
Una dispersione colloidale è un sistema (mezzo continuo) nel quale le particelle si trovano in uno stato finemente disperso.
- Fase dispersa: le particelle
- Fase disperdente: il mezzo continuo
Sono talmente piccole da non risentire del campo gravitazionale abbastanza da sedimentare.
I solidi colloidali presentano diametri
Le particelle hanno dimensioni tali per cui risulta individuabile una superficie di separazione (interfaccia) tra esse e la fase disperdente.
Nei sistemi colloidali, sia la fase dispersa che la disperdente possono trovarsi allo stato solido, liquido o gassoso. si possono così individuare 8 tipi di sistemi colloidali (escludendo i sistemi gassoso-gassoso).
| Fase Dispersa | Fase Disperdente | Sistema | Esempio |
|---|---|---|---|
| Liquido | Gas | Aerosol liquido | Nebbia |
| Solido | Gas | Aerosol solido | Fumi |
| Gas | Liquido | Schiuma | Schiume |
| Liquido | Liquido | Emulsione | Latte |
| Solido | Liquido | Sospensione colloidale | Sol |
| Gas | Solido | Schiuma solida | Poliestere Espanso |
| Liquido | Solido | Emulsione solida | Opale |
| Solido | Solido | Sospensione solida | Plastiche pigmentate |
- [?] Il libro dice che le particelle di natura argillosa sono colloidi idrofobi. Ma le argille non sono considerate terre attive proprio perché accumulano acqua al loro interno? Samuele Maceroni Gode
Le particelle colloidali conferiscono caratteristiche indesiderabili alle acque. Vanno pertanto previsti dei trattamenti di rimozione. Per via della natura dei sistemi colloidali, metodi di sedimentazione o filtrazione risulterebbero inefficaci. Si tende quindi a prevedere un'aggregazione dei colloidi stessi al fine di rimuoverli dalle acque.
Proprietà delle particelle colloidali
Immergendo una sospensione colloidale in un Campo elettrico si nota che le particelle tendono a spostarsi verso uno dei due elettrodi. Si dice cioè che sono soggette a Elettroferesi.
Questo fenomeno è indicazione che le particelle colloidali sono dotate di una certa carica elettrica.
La carica elettrica è ciò che conferisce stabilità alle sospensioni colloidali.
La carica elettrica può essere acquisita attraverso vari meccanismi:
- Imperfezioni nella struttura cristallina: Talvolta una particella colloidale può acquisire una carica elettrica come risultato di una sostituzione isomorfa di alcuni atomi nella struttura cristallina. Ciò è tipico delle particelle di natura argillosa, in cui l'alluminio va a sostituire un atomo di silicio che si trova al centro di un tetraedro. Questo conferisce alla particella una carica netta negativa.
- Adsorbimento preferenziale: alcune particelle colloidali possono acquisire in soluzione acquosa una carica elettrica per adsorbimento di ioni sulla loro superficie. Tipicamente anioni (carica negativa)
- Dissoluzione di Ioni: ???
- Ionizzazione: alcune particelle colloidali possono assumere carica elettrica per ionizzazione dei propri gruppi funzionali. È un comportamento tipico delle proteine
Le particelle colloidali, abbiamo detto sono dotate di carica elettrica. La dispersione colloidale però risulta complessivamente neutra.
La carica della singola particella colloidale deve pertanto essere in qualche modo controbilanciata da cariche di segno opposto; gli ioni che svolgono questa funzione sono detti controioni.
Per descrivere la distribuzione delle cariche si fa riferimento al potenziale elettrico attorno alla particella colloidale. A tale scopo, si adotta in genere il #Modello di Stern.
Modello di Stern
Supponiamo che la particella colloidale sia carica negativamente.
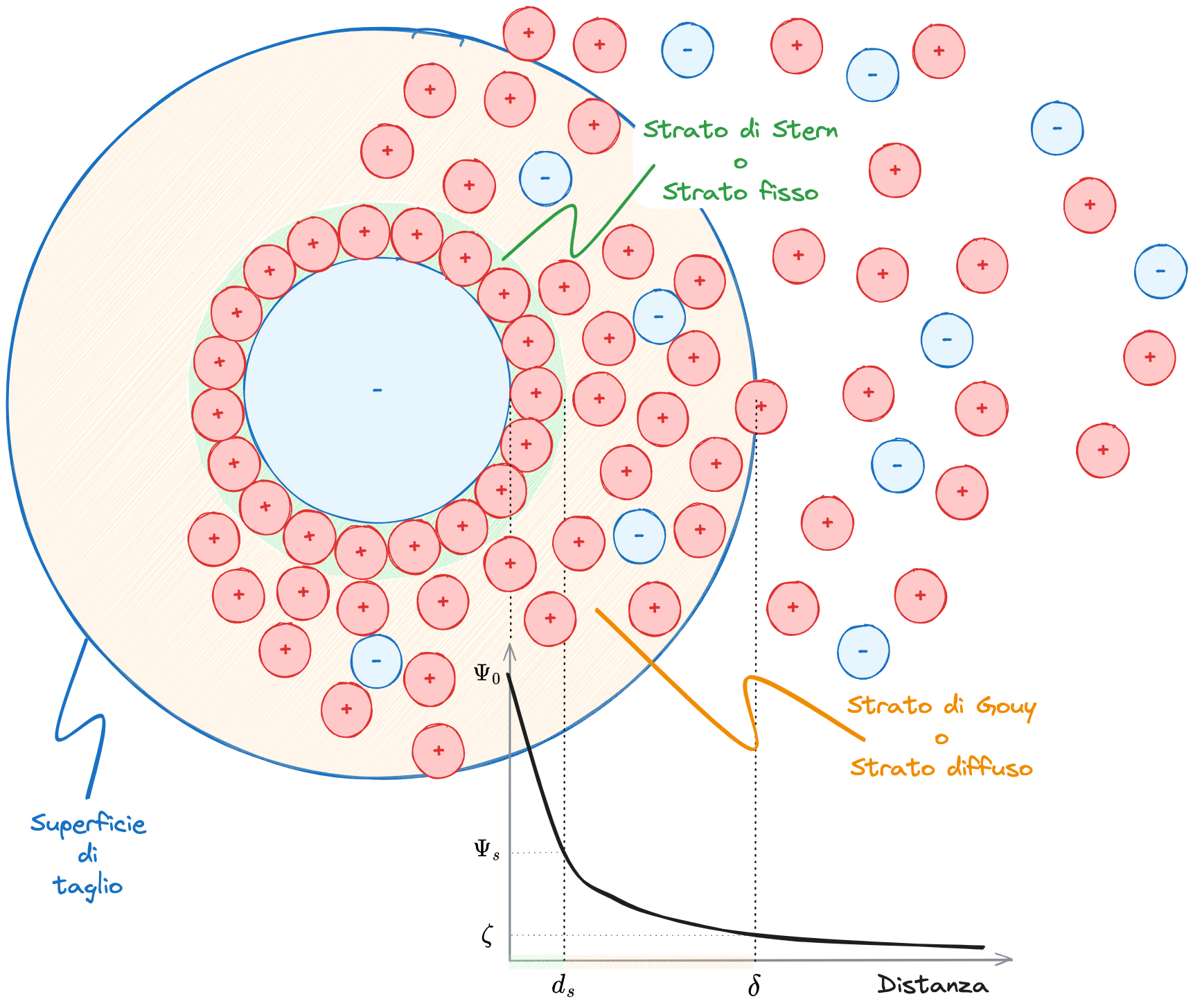
Attorno alla particella carica, andranno a crearsi due strati di controioni:
- #Strato di Stern o fisso
- #Strato diffuso o di Gouy
Il potenziale elettrico all'interno dello #Strato di Stern diminuisce all'aumentare della distanza dal valore, detto potenziale di Nerst al valore (potenziale di Stern).
All'interno dello #Strato diffuso il potenziale decresce in modo esponenziale con la distanza dalla superficie della particella, tendendo a zero a una distanza corrispondente al punto in cui si può considerare trascurabile l'effetto della particella colloidale.
Sottoponendo la particella a un Campo elettrico, questa inizierà a migrare verso uno dei due elettrodi (in questo caso l'elettrodo positivo).
Nel moto, la particella trascinerà con se uno sciame di ioni:
- Lo strato fisso
- Gli ioni dello #Strato diffuso che risentono maggiormente dell'azione della particella rispetto a quella del campo elettrico
In conseguenza a ciò si creerà una superficie di separazione tra lo sciame di ioni che seguono la particella nel suo moto e il resto del mezzo disperdente. Questa superficie è detta #Superficie di Taglio.
Il valore del potenziale in corrispondenza di tale superficie viene assunto come valore caratteristico della curva di potenziale. È detto #Potenziale zeta (
Potenziale Zeta
Il potenziale zeta è definito come
dove:
Carica della particella Distanza della [[#Superficie di taglio]] Costante dielettrica del mezzo disperdente
Più è elevato il potenziale zeta, maggiore è l'intensità delle forze repulsive all'interno del sistema colloidale.
La determinazione del potenziale avviene per mezzo della misurazione della Mobilità elettroforetica,
dove:
Noto il valore della mobilità elettroforetica, il potenziale zeta si ricava come:
dove:
costante di proporzionalità Viscosità del della fase disperdente Costante dielettrica della fase disperdente
Strato di Stern
<-- #Modello di Stern
La particella, per via della sua carica, tenderà ad attrarre controioni positivi tutto intorno alla propria superficie. Si formerà così, intorno ad essa uno strato di ioni, detto strato di Stern. Essendo le forze elettriche a queste distanze alquanto elevate, questo strato prende anche il nome di Strato fisso
Lo strato di Stern è il primo strato attorno alla particella colloidale, costituito da controioni (ioni di carica opposta alla particella).
Strato diffuso
<-- #Modello di Stern
Lo strato diffuso è il secondo strato attorno a una particella colloidale. Questo è costituito ancora prevalentemente da controioni, ma le forze attrattive non sono uguali a quelle dello [[#Strato di Stern]]. Inoltre, a queste distanze, cominciano ad essere rilevanti le forze di repulsione tra controioni a carica uguale.
La concentrazione di controioni diminuirà allontanandosi dalla particella raggiungendo la concentrazione ionica del fluido indisturbato.
Al contrario, crescerà la concentrazione di ioni dello stesso segno della particella allontanandosi da questa.
Potenziali delle forze attrattive e repulsive
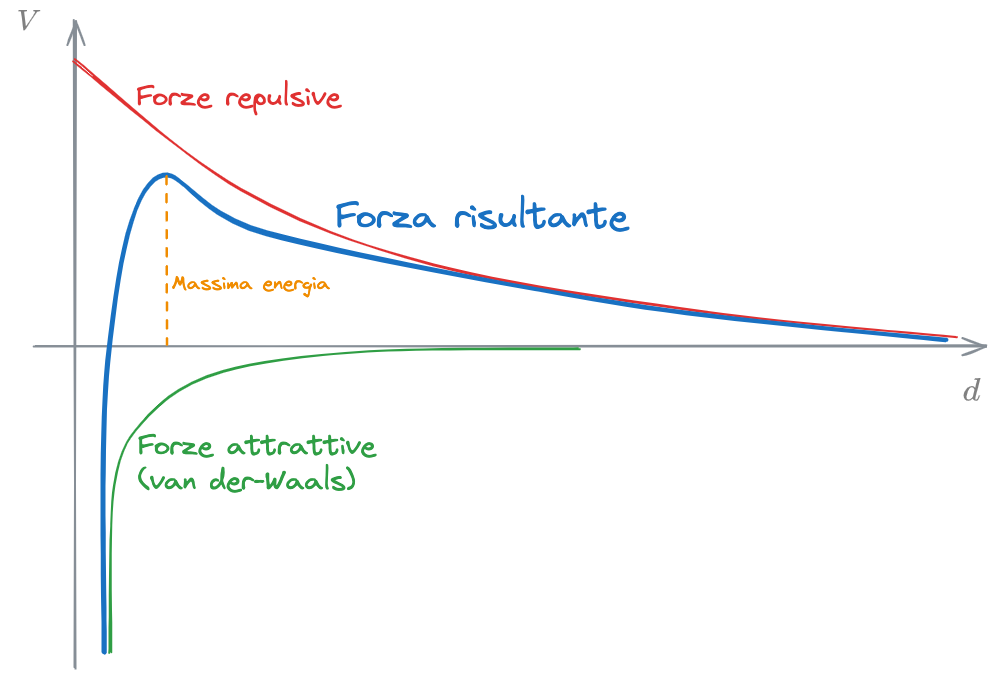
Nel diagramma sono mostrati gli andamenti delle forze repulsive e attrattive (espresse in termini di potenziale) che si generano tra due particelle, in funzione della distanza tra esse.
- Forze repulsive: particelle circondate da controioni della stessa carica
- Forze attrattive: Dovuto alle Forze di London-van der Waals
In blu è riportato l'andamento della forza risultante, ottenuto sommando algebricamente le forze attrattive a quelle repulsive.
Risulta evidente che, affinché le particelle possano entrare in contatto e aggregarsi, queste devono essere abbastanza vicine tra loro, così che le forze attrattive siano predominanti su quelle repulsive.
Occorrerà quindi che nel sistema colloidale ci sia sufficiente energia cinetica da portare le particelle a distanze così ravvicinate.
Destabilizzazione delle particelle colloidali
Si è detto inizialmente che, per eliminare le particelle colloidali dal sistema che si vuole ripulire, occorre trovare un modo di aggregarle in fiocchi di dimensioni adatte a sottostare processi di Sedimentazione o filtrazione.
Si dice che occorre destabilizzare il sistema colloidale, portando le particelle a distanze abbastanza ridotte tali per cui le forze attrattive superino quelle repulsive, come accennato in #Potenziali delle forze attrattive e repulsive.
La destabilizzazione può essere ottenuta principalmente in 4 modi i quali sono divisi tra metodi di #Coagulazione o #Flocculazione
- #Coagulazione
- #Compressione del doppio strato
- #Adsorbimento e neutralizzazione di carica
- #Flocculazione
3. #Inglobamento in un precipitato
4. #Effetto ponte da parte di poli elettroliti
La destabilizzazione è in ogni caso un processo chimico-fisico:
- Chimico: si aggiungono delle specie (agenti coagulanti) per far coagulare le particelle colloidali
- Fisico: le particelle a un certo punto saranno aggregate e verranno rimosse meccanicamente per 6. Sedimentazione
Coagulazione
I meccanismi di #Compressione del doppio strato e #Adsorbimento e neutralizzazione di carica sono generalmente indicati come meccanismi di coagulazione.
I meccanismi di coagulazione sono meccanismi di #Destabilizzazione delle particelle colloidali attraverso i quali viene neutralizzata la carica elettrica delle particelle.
Compressione del doppio strato
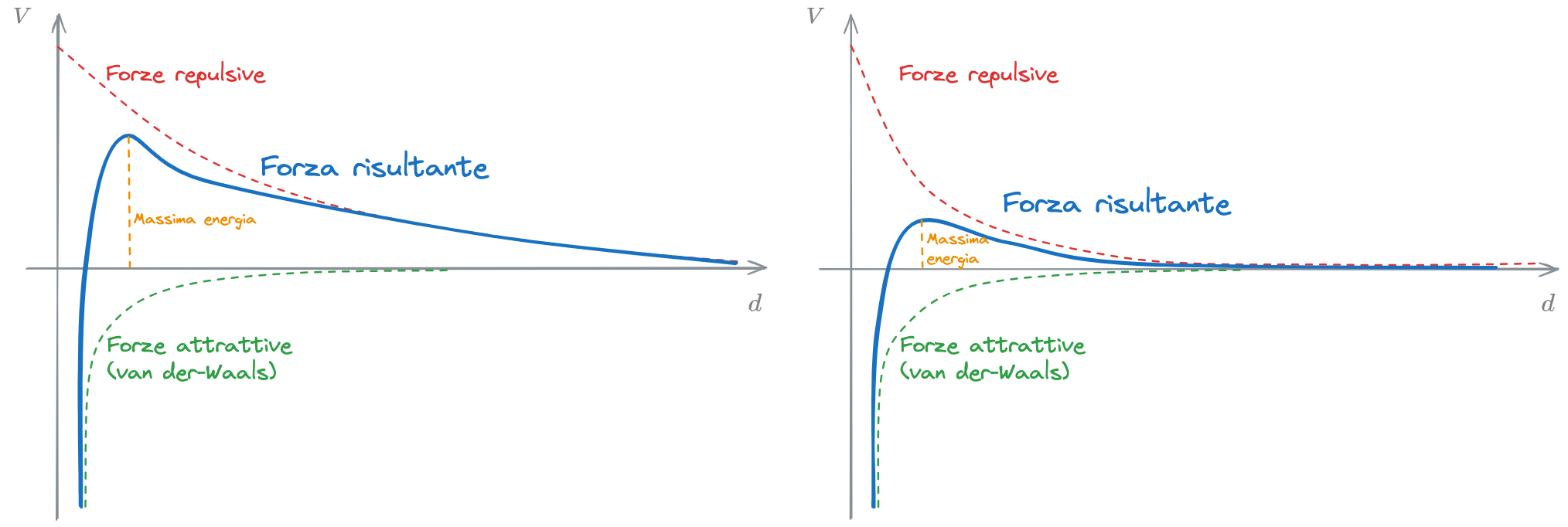
La compressione del doppio strato consiste concettualmente nello schiacciare la curva del potenziale delle forze repulsive in modo da abbassare l'energia necessaria a far prevalere le forze di van der-Waals su quelle repulsive.
Si rappresenta la concentrazione degli ioni in funzione della distanza dalla superficie libera dello Strato Fisso.

Si ricorda che stiamo supponendo di avere una particella carica negativamente. Nel grafico è quindi raffigurato l'andamento della concentrazione di cationi (+) e anioni (-) in funzione della distanza dalla superficie dello strato fisso.
Risulta ovvio, secondo le considerazioni fatte nel #Modello di Stern, che la concentrazione di Cationi (C) tenderà a diminuire con la distanza, mentre la concentrazione degli Anioni (A) tenderà ad aumentare. Si noti che ci sarà una certa distanza (D) a partire della quale le cariche positive e negative si eguagliano.
La compressione a doppio strato consiste nell'aggiungere degli elettroliti alla dispersione colloidale, così da aumentare le concentrazioni di cationi e anioni. In questo modo, la condizione di uguaglianza delle cariche viene raggiunta per distanze (D') minori. Questo in breve favorisce la #Coagulazione delle particelle.
La scelta degli elettroliti non è casuale ma segue piuttosto la #Regola di Schulze-Hardy
Regola di Schulze-Hardy
Per avere una #Compressione del doppio strato ottimale, vogliamo aggiungere specie che forniscano ioni con
- Raggio ionico piccolo
- In grado di dare cationi con elevata valenza
La concentrazione della specie da aggiungere, può essere rapportata alla valenza degli ioni che è in grado di fornire secondo l'equazione
conosciuta come Regola di Schulze-Hardy.
Adsorbimento e neutralizzazione di carica
Abbassare (traslare) la curva del potenziale.
Uso particelle capaci di adsorbirsi sulla superficie della particella - lì cambia la carica --> abbasso il potenziale
Il rapporto non dipende più dalla #Regola di Schulze-Hardy ma è stechiometrico. La neutralizzazione è diretta. Se si utilizza questo meccanismo si raggiunge la #Destabilizzazione delle particelle colloidali con dosaggi molto bassi.
Di contro, un sovradosaggio può causare l'inversione della carica elettrica delle particelle colloidali, ristabilizzando la sospensione.
46:45
Flocculazione
I meccanismi di #Inglobamento in un precipitato e #Effetto ponte sono indicati come meccanismi di flocculazione.
I meccanismi di flocculazione sono i meccanismi di [[#Destabilizzazione delle particelle colloidali]] responsabili dell'aggregazione delle particelle colloidali.
Inglobamento in un precipitato
L'inglobamento in un precipitato è il più comune dei meccanismi di [[#Destabilizzazione delle particelle colloidali]].
Gli elettroliti che vengono aggiunti a un certo punto cominciano a precipitare.
In questo caso la destabilizzazione consiste in...:
aggiungo elettrolita; a un certo punto si formano i nuclei di condensazione. Man mano che aggiungo elettroliti i nuclei aumentano e si accrescono. Man mano che si accrescono, lo fanno usando le particelle colloidali. Il nucleo di condensazione inizialmente è la stessa particella colloidale. Vengono inglobate fisicamente nel precipitato che man mano si accresce. LE particelle colloidali fungono da nucleo di condensazione e vengono inglobate nel precipitato. Per via fisica poi le possiamo rimuovere.
I coagulanti che si usano sono solitamente sali di allumino e ferro trivalenti o più raramente composti a base di Magnesio o Calcio.
Si formano nei primi tre casi idrossidi, o carbonato nel caso del calcio
SI aggiunge alla soluzione li sale in quantità inferiore al prodotto di solubilità di quel sale. Si scioglie completamente. Forma specie ioniche in soluzione a seconda di come agisce quell'elemento con le molecole d'acqua.
Prima si forma una specie ionica idrata. Poi dà luogo a tutta un'altra serie di specie.
Negli esempi ci sono Ferro e Alluminio. Sono in forma trivalente. Questo non vuol dire che stanno come ioni Fe3+ o Al3+. A seconda del pH, il ferro o l'Al possono acquisire ioni OH-.
Si formano una varietà di specie ioniche. Sia anioni che cationi, a seconda del pH.
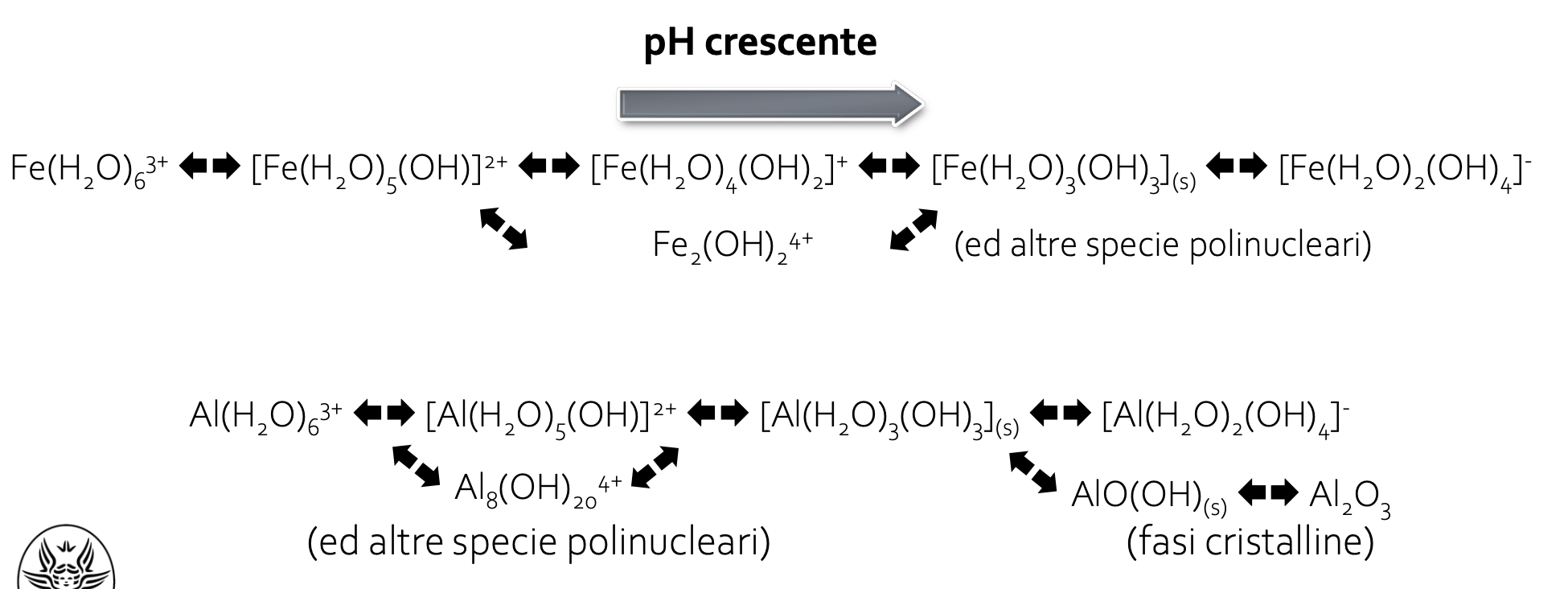
Come si fa per descrivere complessivamente la situazione che si ha in soluzione?
Generalmente si rappersenta il diagramma
Per ogni specie ionica che si può avere si traccia una retta.
Se vogliamo sapere in una determinata condizione di pH, qual è la concentrazione complessiva di Al, sapendo che può essere presente in diverse forme, dobbiamo sommare i contributi di ogni curva.
Otteniamo così la concentrazione totale di alluminio in soluzione.
La linea in grassetto è la somma di tutte le specie di Al al variare del pH.
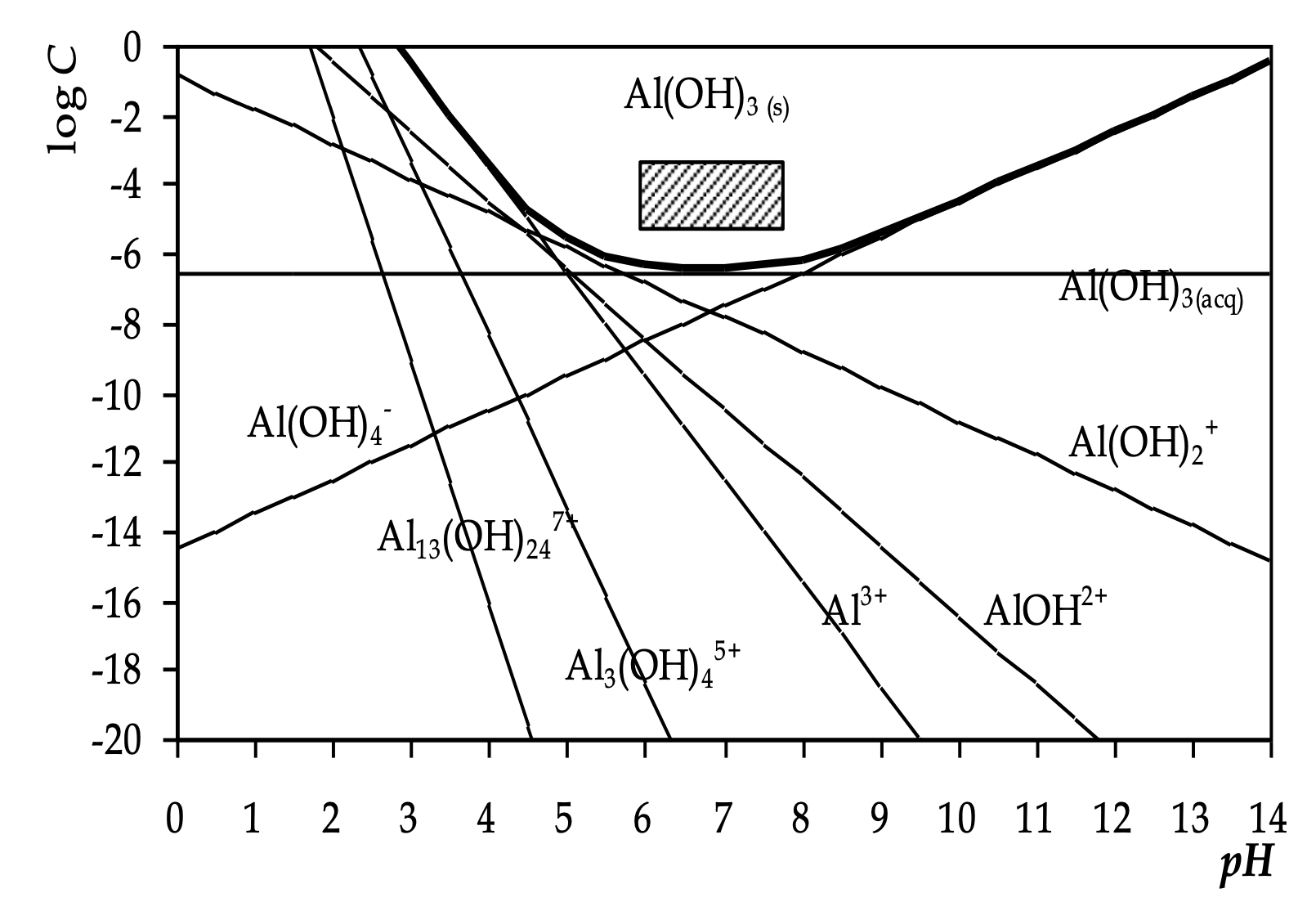
Tipicamente la curva ha una forma a campana (per metalli anfoteri). Questa curva ci dice una cosa importantissima, rappresentata dal quadratino.
Per come l'abbiamo ricavata, quella curva è la concentrazione totale di quel metallo disciolta al variare del pH. Se aggiungo una certa quantità di alluminio alla soluzione e vedo che nella soluzione, a seconda del pH me ne trovo di più o di meno, mi sono perso qualcosa. Quello che manca, dove è andato a finire? È precipitato. La curva, rappresenta la curva di solubilità della specie solida che si può formare quando si eccede la curva di solubilità. È la specie solida che si può formare avendo aggiunto alluminio. In questo caso, l'idrossido di alluminio.
Se mi metto a un pH intermedio (6.2), la curva mi da un valore basso. Esiste un minimo di concentrazione totale in soluzione di alluminio che può essere presente. A un pH diverso la solubilità è più elevata: riesco a sciogliere di più = precipita di meno (ai lati della curva).
Immaginiamo di aggiungere alla soluzione una quantità di alluminio in grado di raggiungere una concentrazione di
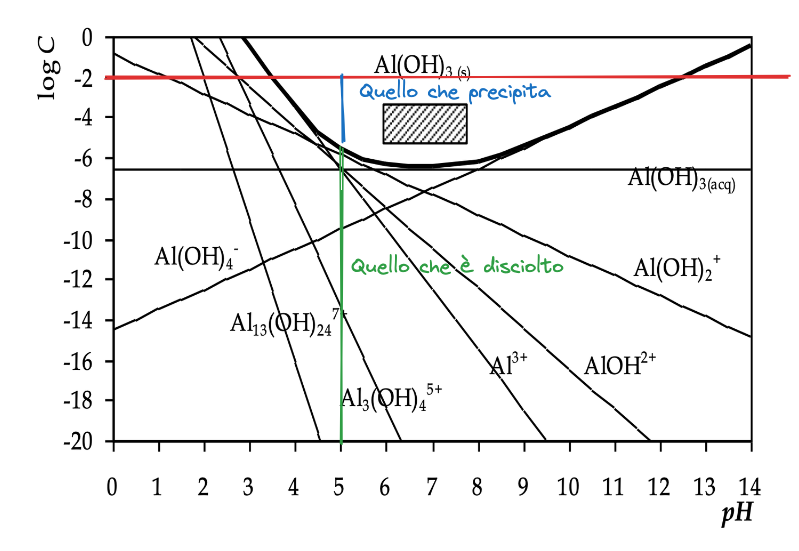
Se noi aggiungiamo alla soluzione una concentrazione
a pH 5, vedo sotto la curva in grassetto la quantità che è disciolta. La differenza tra quello che ho aggiunto e quello disciolto è quello che precipita.
Al di sopra della curva l'alluminio presente è solido. Sotto è disciolto. In che forma? Dipende dal pH.
Questo meccanismo, di formazione del precipitato, implica anche un altro effetto. Si formano anche specie in forma ionica. Se ho inglobamento in un precipitato, ho anche un altro meccanismo: ho un effetto sul doppio strato elettrico.
Poiché l'alluminio è piccolo e trivalente, agisce come meccanismo di #Compressione del doppio strato.
Effetto ponte
Effetto ponte da parte di polielettroliti:
- Composti naturali (amido, cellulosa)
- Polimeri organici di sintesi.
Sono impiegati come agenti coagulanti. Si sfrutta come meccanismo aggiuntivo. È fatto per migliorare l'effetto degli altri meccanismi.
Questi polielettroliti, secondo varie interazioni, sono in grado di attrarre le particelle colloidali. Sono molecole abbastanza lunghe con ramificazioni. Queste ramificazioni interagiscono con le particelle colloidali attraendole.
La particella si attacca a una delle ramificazioni del polielettrolita. se succede per più particelle può formarsi un fiocco che contenga più particelle con più elettroliti.
Se noi esageriamo col dosaggio di polielettroliti rispetto ai colloidi, si può avere una nuova stabilizzazione delle particelle.
È importante stare attenti al dosaggio.
RICAPITOLANDOLO
L'intero processo di destabilizzazione è fatto di varie fasi:
- COAGULAZIONE: Dopo aver aggiunto l'elettrolita, devo fare in modo di disperderlo efficacemente, uniformemente, rapidamente l'elettrolita nella sospensione colloidale
- FLOCCULAZIONE: L'agente coagulante interviene producendo coagulazione: quindi favorisce formazione di fiocchi
- SEDIMENTAZIONE Devo far sedimentare i fiocchi
Un processo di 07. Coagulazione e Flocculazione ha sempre come ultima fase un processo di Sedimentazione.
Alle 3 fasi corrispondono tipi di miscelazione diversi:
- Coagulazione: miscelazione rapida
- Flocculazione: devo favorire che si incontrino i singoli agglomerati. Devo avere un po' di miscelazione. Se è troppo vigorosa, rischio di creare sforzi di taglio che rompono i fiocchi. Miscelazione blanda
- sedimentazione: idealmente NO miscelazione
In genere per distinguere le varie fasi si usa un parametro che è una misura del grado di agitazione che si adotta.
Potenza dei dispositivi di agitazione Viscosità - più è viscoso, meno è facile agitare, minore è il grado di agitazione Volume
Il gradiente di velocità è nell'ordine di:
1000 s^-1 per #Coagulazione
30 s^-1 per #Flocculazione
È un parametro di dimensionamento