05. Parametri di caratterizzazione delle acque
5. Parametri di caratterizzazione delle acque
Vogliamo studiare l'effetto dello versare un certo liquido in un qualche corpo.
Ci sono molte tipologie di inquinanti, una lista è fornita di seguito:
- #Solidi (plastiche o altro...)
- #Sostanze Organiche Biodegradabili
- #Macronutrienti (Azoto
, Zolfo ) - #Tensioattivi - i saponi (Surf Actants - Surface Active Agents) --> Favoriscono lo schiumeggiamento
- Oli, #Grassi
- #Sostanze Organiche Refrattarie (alla biodegradazione) tossiche - Idrocarburi, idrocarburi aromatici...
- #Metalli pesanti - "Pesanti" in realtà non è un termine ufficiale. Hanno densità
- Metalli tossici + metalloidi (arsenico - tipico delle acque potabili nel viterbese) - #Micro organismi patogeni - In grado di veicolare malattie
- #Micro e Nano plastiche
- #Temperatura (T)
- #pH
Solidi
In questo contesto consideriamo i reflui civili --> Derivanti da una fognatura mista:
pioggia + scarico degli edifici
- Acque nere
- Specie solide urbane
Conferiscono torbidità all'acqua.
Il loro effetto è negativo per:
- Fattore estetico
- Riducono
- Scambi di gas
- Passaggio di luce
La classificazione degli inquinanti solidi si può fare in tre modi:
- #Classificazione dimensionale
- #Classificazione basata sul contenuto di sostanza organica
- #Classificazione basata sulle caratteristiche fisiche
Classificazione dimensionale
Classificazione basata sul contenuto di sostanza organica
.

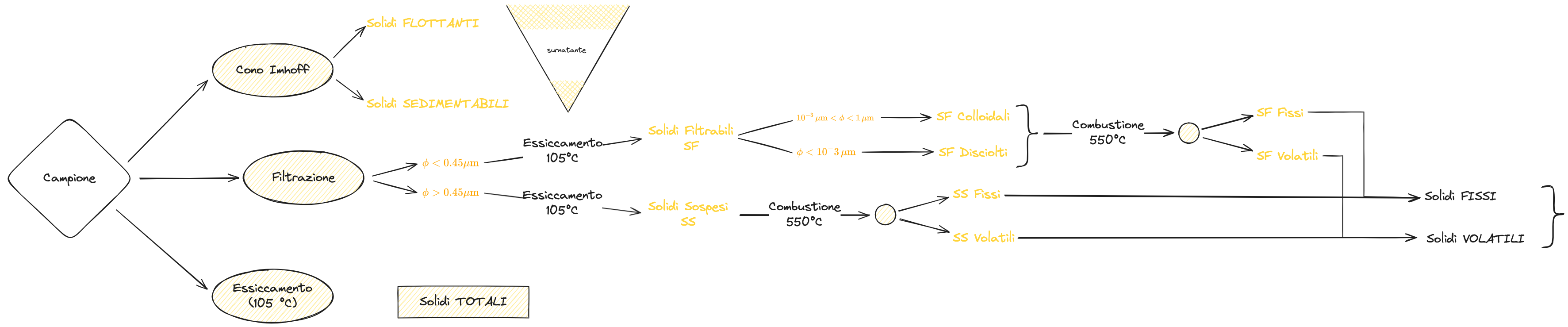
Sono interessato a conoscere la concentrazione di solido rispetto al totale del liquido in mio possesso.
Per farlo si segue il processo schematizzato:
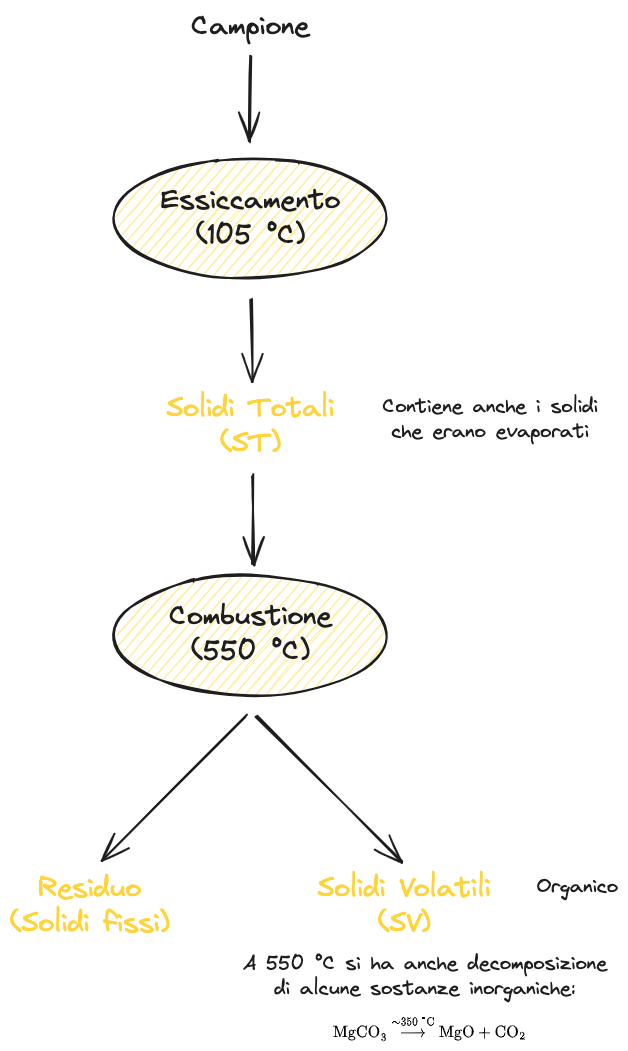
In generale per distinguere tra solidi organici e inorganici si può con buona approssimazione fare riferimento alla combustione. La sostanza organica è combustibile, pertanto se la brucio sparisce dal campione. In questo modo posso ricavare la concentrazione che aveva prima di essere bruciata
In realtà, durante la combustione, anche una parte di solido inorganico viene bruciata.
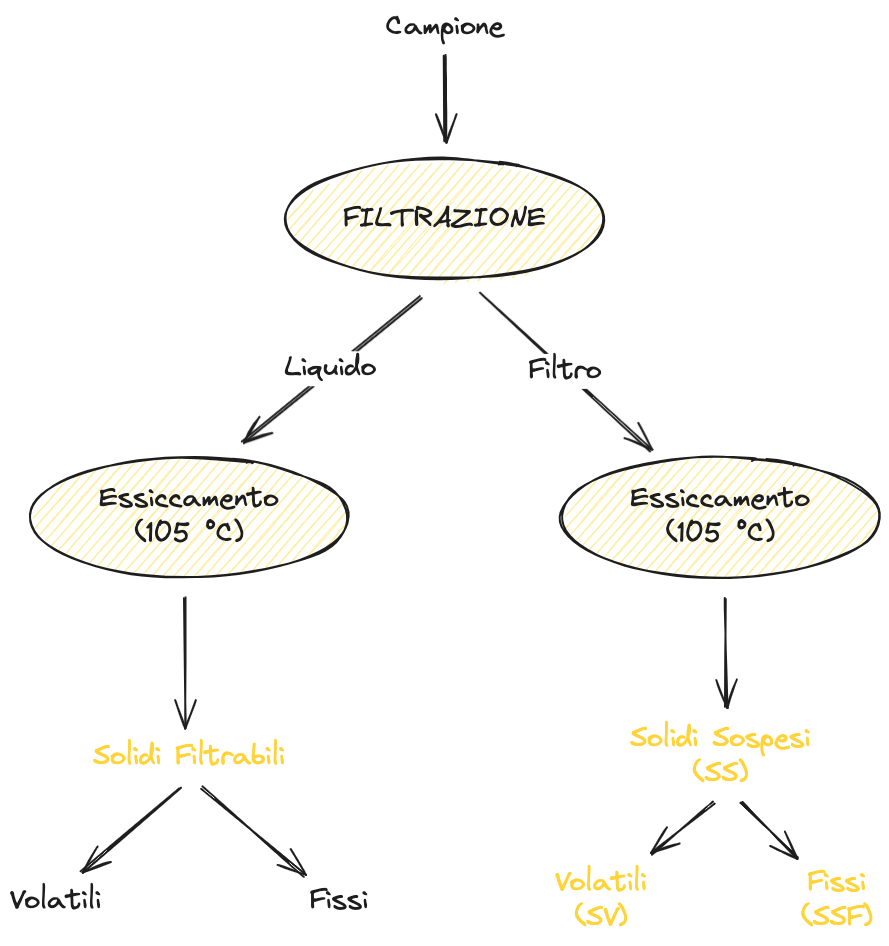
Filtrazione
Un ulteriore #Classificazione dimensionale si ha tramite filtrazione. Un secondo campione viene sottoposto a filtrazione - Le particelle di dimensione maggiore saranno trattenute dal filtro, mentre le più piccole lo attraverseranno.
Si fornisce una schematizzazione del processo di filtrazione.
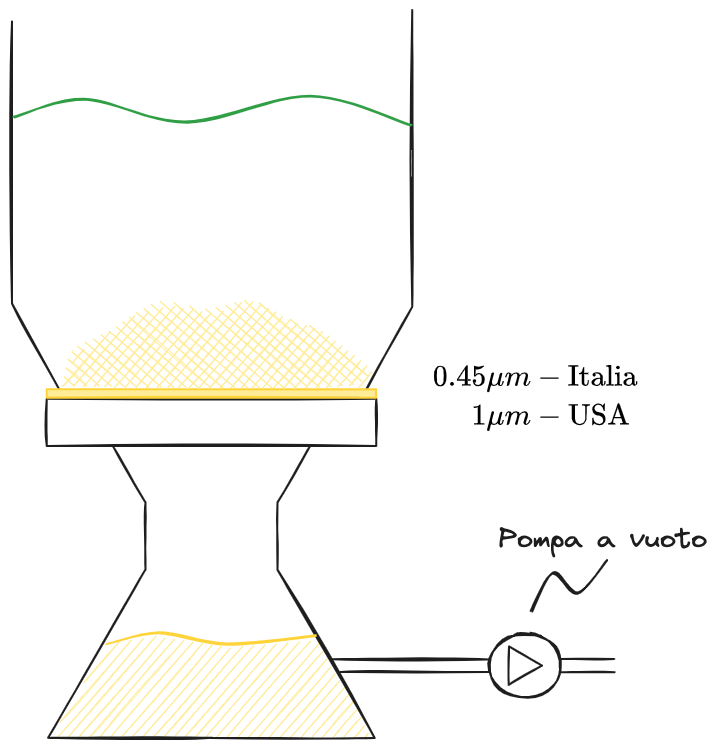
Per la filtrazione si segue il seguente processo:
Sulla base delle dimensioni e delle caratteristiche, si può fare la classificazione schematizzata di seguito:
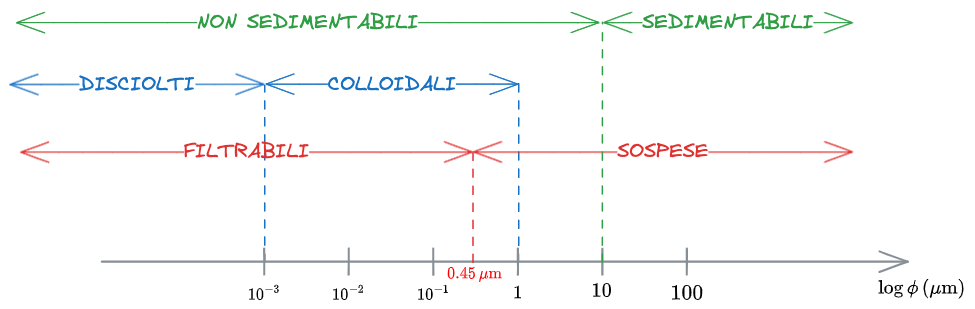
Per sedimentabili si intende in realtà: rimovibili per sedimentazione in un tempo ragionevole.
Disciolti: Equivale a ciò che è presente in forma ionica
Solidi Filtrabili
< #Filtrazione
[[04. Parametri di caratterizzazione delle acque 2023-11-07 11.40.16.excalidraw.png]]
Solidi Sospesi (SS)
< #Filtrazione
[[04. Parametri di caratterizzazione delle acque 2023-11-07 11.40.16.excalidraw.png]]
Solidi Volatili (SV)
< #Filtrazione
[[04. Parametri di caratterizzazione delle acque 2023-11-07 11.40.16.excalidraw.png]]
Solidi Sospesi Fissi (SSF)
< #Filtrazione
[[04. Parametri di caratterizzazione delle acque 2023-11-07 11.40.16.excalidraw.png]]
Classificazione basata sulle caratteristiche fisiche
Sostanze Organiche Biodegradabili (SOB)
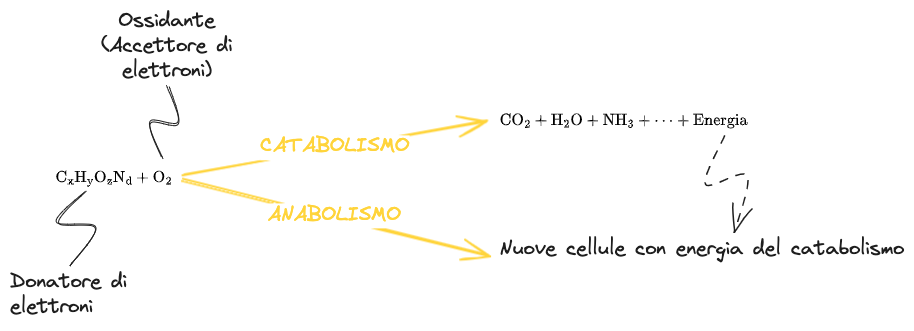
Le Sostanze Organiche Biodegradabili (SOB) sono sostanze che possono essere usate da alcune specie nel loro metabolismo.
Le sostanze organiche (#Substrato) vengono degradate da particolari organismi (#Biomassa) che le usano come nutrimento, sfruttandole come fonte di energia per le funzioni di crescita, le funzioni vitali e come fonte di carbonio per la produzione di altre cellule.
L'energia viene prodotta attraverso delle reazioni di ossidazione - in un processo detto Catabolismo - nelle quali la SOB viene convertita in prodotti finali quali
L'energia prodotta in tale fase viene poi usato per la produzione di nuove cellule in un processo detto invece di #Anabolismo. La fonte di carbonio in questa fase viene ancora dalla SOB.
Se nel refluo ci sono SOB, in presenza di
L'ossigeno disperso nel liquido viene consumato e si instaura un equilibrio in cui l'
Qualora non si riuscisse a rimpiazzare l'ossigeno abbastanza velocemente, si creerebbe uno squilibrio. La concentrazione di ossigeno (
In alcuni casi si può anche arrivare all'#Eutrofizzazione.
È complicato quantificare con precisione la quantità di SOB presente in un liquido. Si può però ragionare in termini di ossigeno consumato equivalente. Guardiamo alle SOB globalmente come l'effetto che producono.
Si definisce così la #Richiesta Biochimica di Ossigeno (BOD)
Eutrofizzazione
Un fenomeno che si verifica quando c'è un notevole apporto di SOB.
In presenza di ossigeno si sviluppano delle specie in grado di degradare le SOB (come le piante acquatiche). Queste specie raggiungono il loro fine di ciclo vitale.
Morendo, si depositano sul fondo del corpo idrico andando a costituire altra SOB.
Per la loro degradazione viene consumato ancora più ossigeno.
Si ha così degradazione continua anche in assenza di ossigeno (condizioni anaerobiche)
I prodotti sono gassosi e maleodoranti (ad es.
Si avvertono i segni della putrefazione.
Richiesta Biochimica di Ossigeno (BOD)
La Richiesta Biochimica di Ossigeno (BOD) - dall'inglese Biochemical Oxygen Demand - permette di quantificare la quantità di SOB presente in un liquido, guardando alla quantità di ossigeno che è necessaria per biodegradare la sostanza.
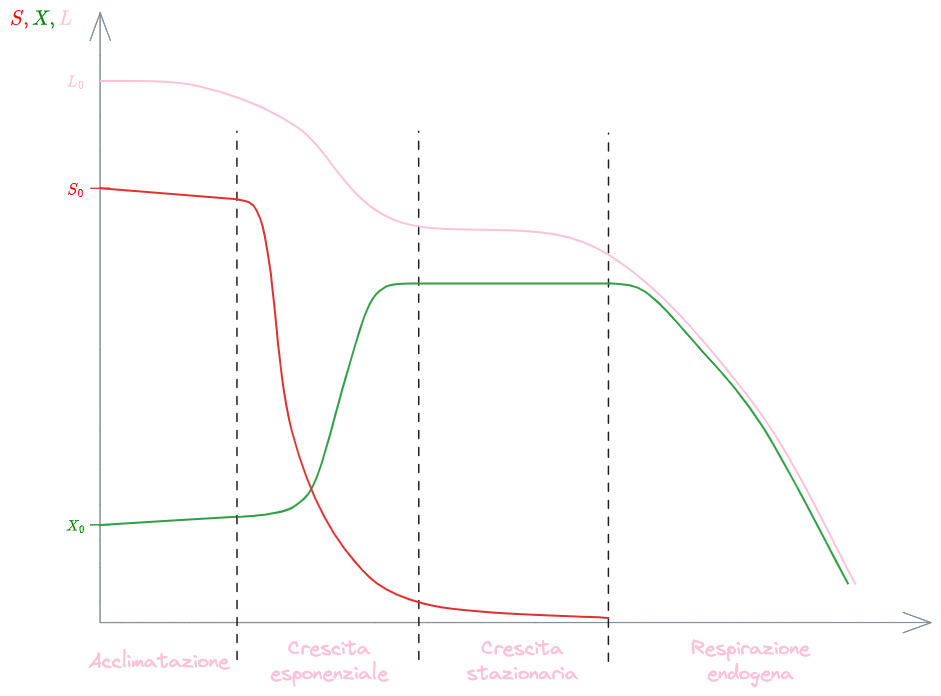
Si suppone di avere un reattore di Batch. In questo reattore si aggiungono della SOB che chiameremo #Substrato e della #Biomassa (i micro organismi). Ognuno avrà le rispettive concentrazioni:
- #Substrato - Concentrazione iniziale
- #Biomassa - Concentrazione iniziale
Appena introdotti, ci sarà una prima fase detta di #Acclimatazione in cui la biomassa dovrà adattarsi alle nuove condizioni. In questa fase, il numero di micro organismi rimane praticamente costante, mentre si accresce leggermente in massa, andando così a ridurre leggermente la quantità di substrato.
Una volta acclimatata, la biomassa comincerà a consumare il substrato molto velocemente, aumentando di molto la propria concentrazione nel reattore. Questa fase è caratterizzata da una #Crescita Esponenziale della biomassa.
Successivamente, quando il substrato sarà quasi completamente consumato, la biomassa comincerà a nutrirsi di se stessa. In questa fase si raggiunge un equilibrio per cui la crescita di biomassa è uguagliata dal suo consumo. Si tratterà così di una fase a crescita di
Infine, quando il substrato sarà completamente consumato, la biomassa non ha più nulla di cui nutrirsi se non se stessa. Comincerà così a decrescere la sua concentrazione durante questa fase di #Respirazione Endogena.
A patto di misurare le concentrazioni di biomassa e substrato con le stesse unità di misura, e comunque in quantità di ossigeno equivalente, si può dire che la concentrazione di sostanza organica totale presente nel reattore in ogni dato istante è data dalla somma delle due:
definendo la velocità di reazione come
dove dopo il secondo "uguale" si è supposto che il decadimento di
Integrando si ottiene:
Si vede quindi che la Sostanza Organica Totale (SOT) è descritta da una legge esponenziale decrescente che parte da
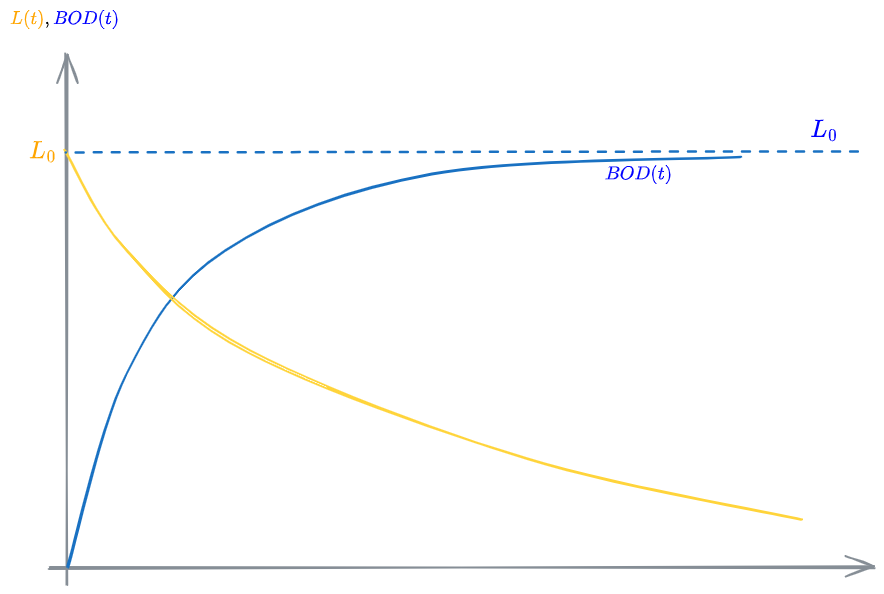
A questo punto si hanno,
Sostanza Organica Totale di partenza misurata in ossigeno equivalente e quindi in quanto ossigeno sarà necessario a degradarla tutta Quanto ossigeno servirà a degradare la SOT presente all'istante .
Per cui la differenza
Se si misura la concentrazione di sostanza organica in BOD, quella differenza sarà anche pari alla #Richiesta Biochimica di Ossigeno in quello stesso istante
che sarà dunque analiticamente pari a:
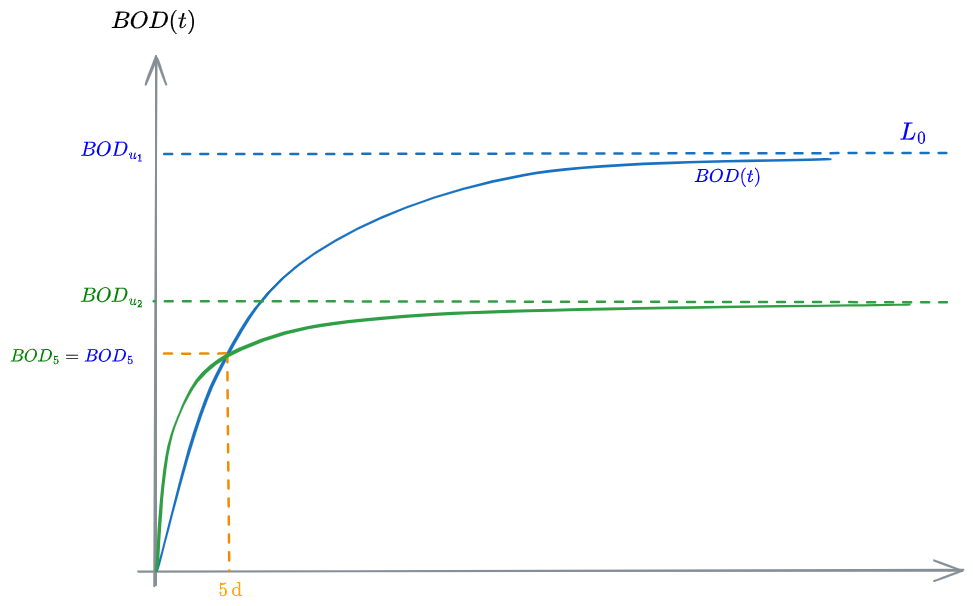
La Richiesta Biochimica di Ossigeno Ultima (
Dove
Per conoscere
In particolare, i valori più diffusi sono a 5 o a 20 giorni:
Essendo l'equazione del
possiamo scrivere per il
Per reflui di tipo civile
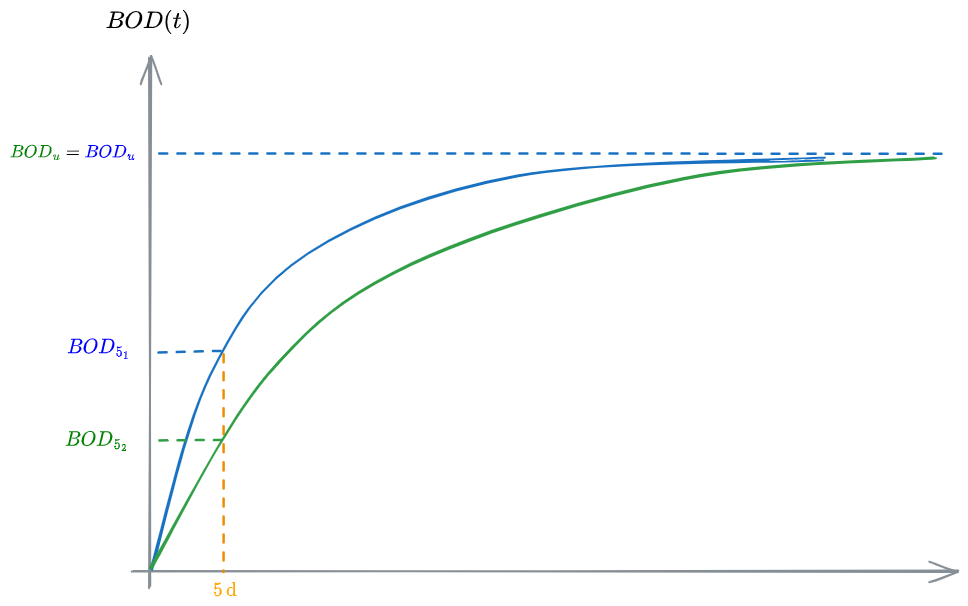
A parità di
Nel caso sopra infatti:
In termini di biodegradabilità, è più degradabile quello con
Allo stesso modo, può verificarsi che due campioni abbiano lo stesso
Misurazione del BOD
Ci sono in linea di massima 3 modi per misurare il BOD:
- #Misurazione del BOD per diluizione
- #Misurazione del BOD con respirometro di Warburg
- #Misurazione del BOD con Respirometro elettrolitico
Misurazione del BOD per Diluizione
Per misurare la #Richiesta Biochimica di Ossigeno (BOD) per diluizione si riempie completamente una bottiglia del campione che si vuole analizzare. Si satura la bottiglia di
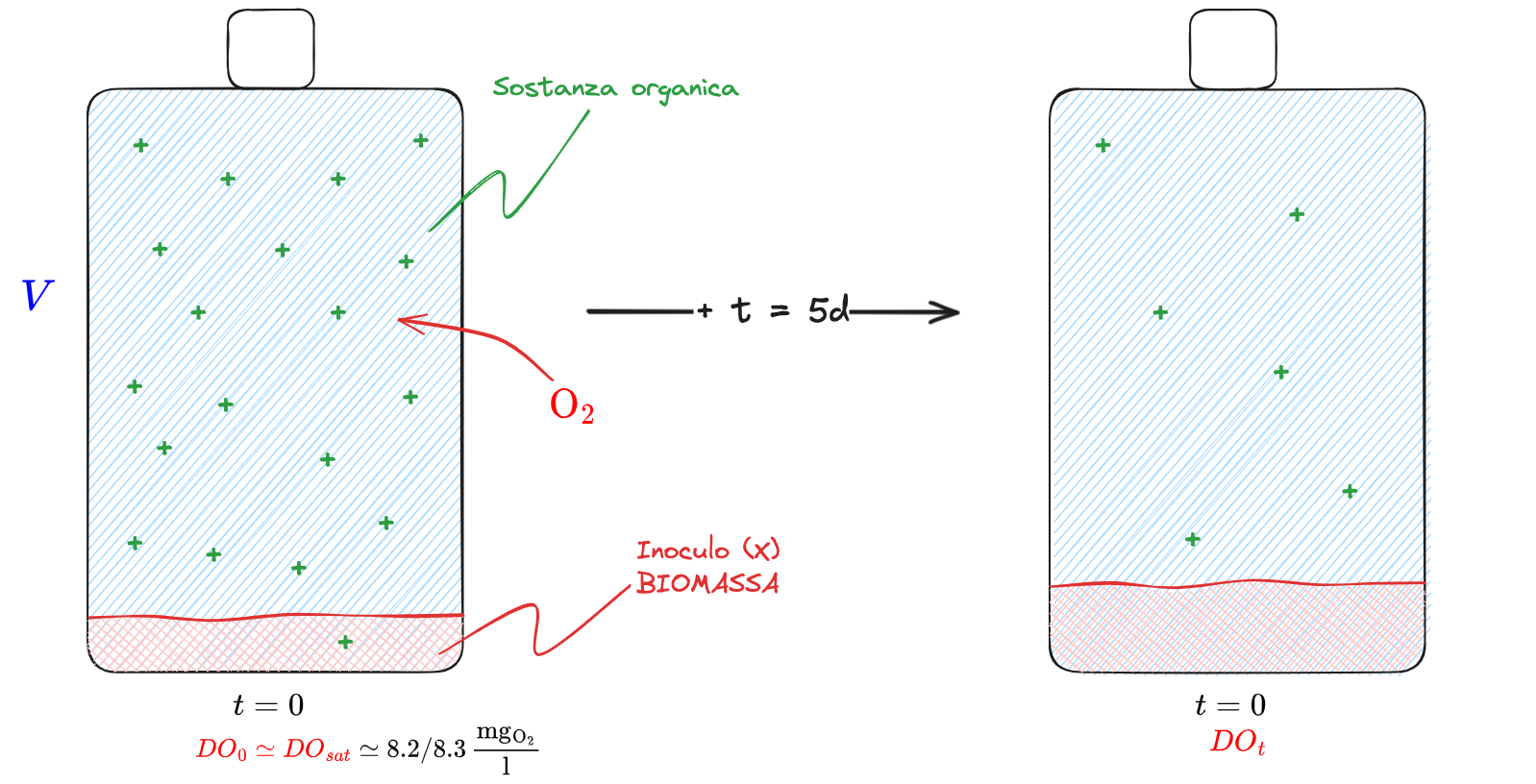
Si lasciano passare 5 giorni. Vorremmo ricavare il
con
La concentrazione di saturazione di Ossigeno Disciolto è nell'ordine di
In realtà, non conoscendo i valori di BOD, non si sa a priori quante volte bisogna diluire.
Non sapendo quanto bisogna diluire, si fanno diversi esperimenti con diversi gradi di diluizione
- Alcune bottiglie avranno
Diluite poco - Alcune bottiglie avranno
Diluite troppo - Alcune bottiglie avranno valori accettabili:
Nell'esecuzione di questa prova, è importante controllare la temperatura, in quanto questa altera l'esperimento.
Misurazione del BOD con Respirometro di Warburg
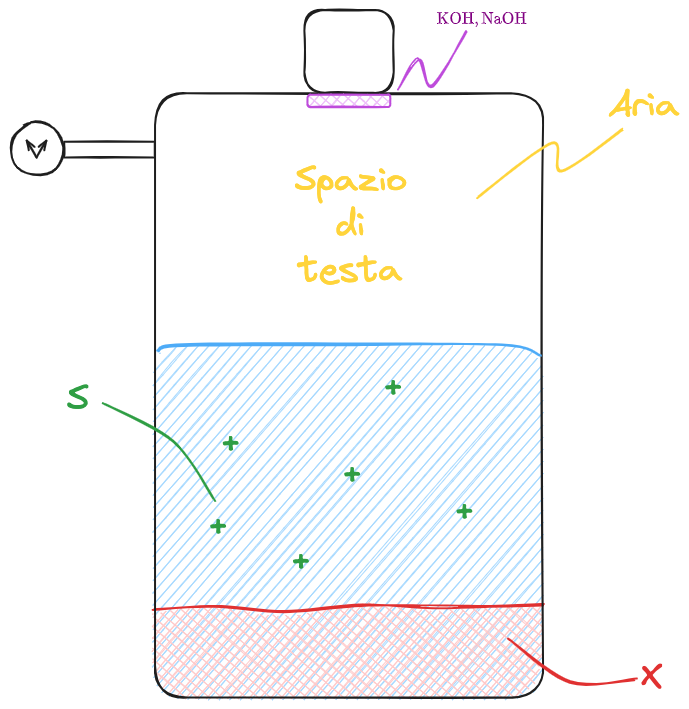
Il respirometro di Warburg sfrutta il fatto che in atmosfera è presente il
All'interno della bottiglia:
Ogni mole di ossigeno consumata, produce una mole di anidride carbonica. La pressione del gas, quindi, rimane costante.
Nel tappo della bottiglia è presente un supporto solido imbevuto di una specie alcalina (
Questo metodo presenta principalmente una criticità: man mano che la reazione procede e l'ossigeno viene consumato, la reazione potrebbe essere rallentata. Per questo motivo spesso si usa un altro metodo e si effettua la [[#Misurazione del BOD con Respirometro elettrolitico]].
Misurazione del BOD con Respirometro elettrolitico
Invece di misurare la variazione di pressione, si fa in modo che questa rimanga costante usando una cella di elettrolisi per reintegrare l'ossigeno consumato all'interno della bottiglia. Ad essere misurato in questo caso è la quantità di ossigeno fornita.
Chemical Oxygen Demand (COD)
La #Richiesta Biochimica di Ossigeno (BOD) impiega giorni per essere misurata. Troppo tempo. Non può pertanto essere usata come una misura di routine. Serve trovare un parametro che sia misurabile nell'ordine di qualche minuto o al massimo di qualche ora.
Esiste un surrogato del BOD, il COD: richiesta chimica di ossigeno
Il COD è la quantità di ossidante che le sostanze organiche (e non) richiedono per essere ossidate.
In realtà al posto dell'ossigeno si usano sostanze ossidanti più energiche, così da compiere le misurazioni più velocemente (es.
Si cerca il più possibile di spostare l'equilibrio della reazione verso destra.
- Temperatura elevata (ebollizione)
- Eccesso di
(ambiente acido) - Catalizzatori
Si misura
Si facilità la reazione:
- Lavorando in ambiente acido (es. acido solforico)
- Lavorando in ebollizione
- Utilizzando catalizzatori
Alla fine avrò parte del
Siccome il
Devo fornire
Possiamo così misurare quanto
- [?] In che modo gli elettroni equivalenti sono legati al COD?
Aggiungo un ossidante. Non sapendo a priori qual è il COD uso un eccesso. Alla fine della prova una parte dell'ossidante è consumata e rimane un residuo non reagito. Per misurare il contenuto di ossidante si ragiona al contrario. Si vede quanto è rimasto non ridotto. La differenza tra il dicromato che avevo all'inizio e quello che avevo alla fine è quello consumato.
La quantità si determina con titolazione. (con ferroammonio solfato). La quantità di ferroammonio solfato si misura tramite titolazione redox usando indicatore che ci dice il punto di equivalenza. Quando la soluzione cambia colore, significa che abbiamo aggiunto tanto ferroammonio solfato quanto necessario.
Rimane da chiedersi che rapporto ci sia tra BOD e COD.
- BOD - Domanda biochimica
- COD - Domanda Chimica -
- Include anche sostanze organiche ossidabili per via chimica, ma non biodegradabili
- Include anche sostanze inorganiche ossidabili per via chimica (cloruri)
Quindi il COD sovrastima il BOD. Il COD però non misura la richiesta biochimica diper ossidare l'azoto.
In definitiva, di solito, per reflui civili:
Macronutrienti
Azoto
È un nutriente per le cellule che però consumano ossigeno accrescendosi (#Eutrofizzazione).
L'azoto può essere trovato in diversi stati di ossidazione:
| Ridotto ( |
Elementare ( |
Ossidato ( |
Ossidato ( |
|---|---|---|---|
| Azoto ammoniacale | Azoto molecolare | Nitriti/Azoto nitroso | Nitrati/Azoto nitrico |
L'azoto può passare da uno stato di ossidazione all'altro a seguito di reazioni biochimiche.
Tutti gli azoti elencati sopra sono considerati inquinanti.
Azoto ammoniacale
L'#Azoto ammoniacale è un gas che si trova disciolto in acqua
dove:
Ammoniaca indissociata Ione ammonio
L'equilibrio della reazione sopra descritta si sposta a destra o sinistra a seconda della concentrazione die quindi del pH. All'aumentare del pH (soluzione più alcalina), l'equilibrio si sposta verso sinistra.
Cerco quanto dell'azoto ammoniacale presente nella reazione si trova nella forma indissociata (
nella quale posso dividere sopra e sotto per la concentrazione
ricordando la costante di equilibrio di una base:
Introducendo ora la costante di protolisi dell'acqua:
si può scrivere
in cui la concentrazione di
Abbiamo quindi trovato la relazione tra il
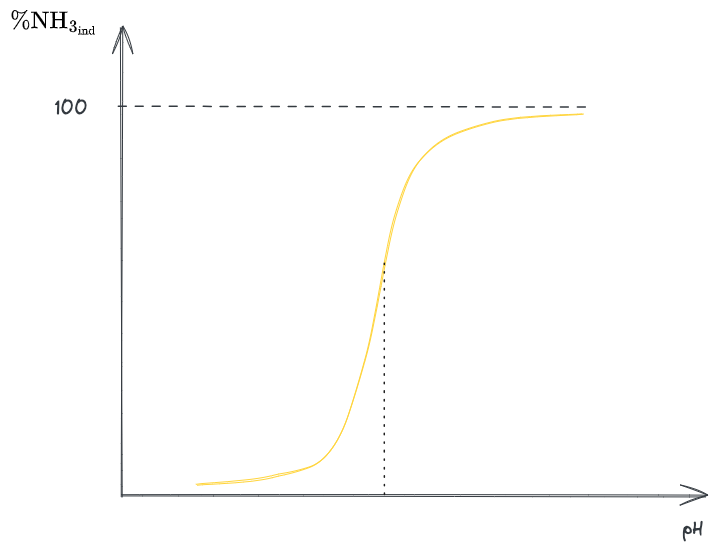
-
[?] Questo grafico, per
, a cosa tende? non tende a 0 vero? - 📅 2023-11-28 -
- Il Carbonio, nel Glucosio ha n.o. pari a 0
Come accennato in precedenza, l'azoto interviene in reazioni di tipo biochimico. Ci sono infatti diversi microrganismi in grado di degradare l'azoto, ed hanno tutti le seguenti caratteristiche:
- Chemiosintetici - Ottengono l'energia per reazioni di sintesi cellulare da reazioni chimiche (esistono anche i fotosintetici)
- Autotrofi - Sintetizzano da soli il Carbonio organico delle cellule a partire da Carbonio inorganico
- Aerobici
In particolare le reazioni di chemiosintesi trasformano, ossidandolo, l'#Azoto attraverso delle reazioni chiamate: #Nitrosazione e #Nitrificazione.
Nitrosazione
Nitrificazione
Nitrificazione finale
La reazione completa, è data dalla somma delle reazioni di #Nitrosazione e #Nitrificazione e si chiama di nuovo nitrificazione:
Questa reazione è il modo in cui i microrganismi chemiosintetici autotrofi aerobici producono energia.
Questa reazione consuma ossigeno. Vi sarà quindi associato un certo BOD (che non è dovuto alla sostanza organica ma all'#Azoto ammoniacale).
In particolare si avrà
Il BOD può essere dovuto principalmente a 2 fattori:
- alla sostanza organica carboniosa (
) --> (Micro)rganismi eterotrofi - alla nitrificazione (
) --> Microrganismi autotrofi
Se nel refluo sono presenti entrambi, il BOD conterà entrambi.
Inoltre gli organismi eterotrofi hanno in genere cinetiche di crescita più rapide degli autotrofi.
Il consumo di Ossigeno da parte dell'Azoto è trascurabile fino a che non inizi a scarseggiare la Sostanza Organica Carboniosa. L'andamento del BOD è così mostrato nel grafico sottostante.
Il primo tratto è indicativo della #Richiesta Biochimica di Ossigeno (BOD) carboniosa, il cui asintoto sarebbe
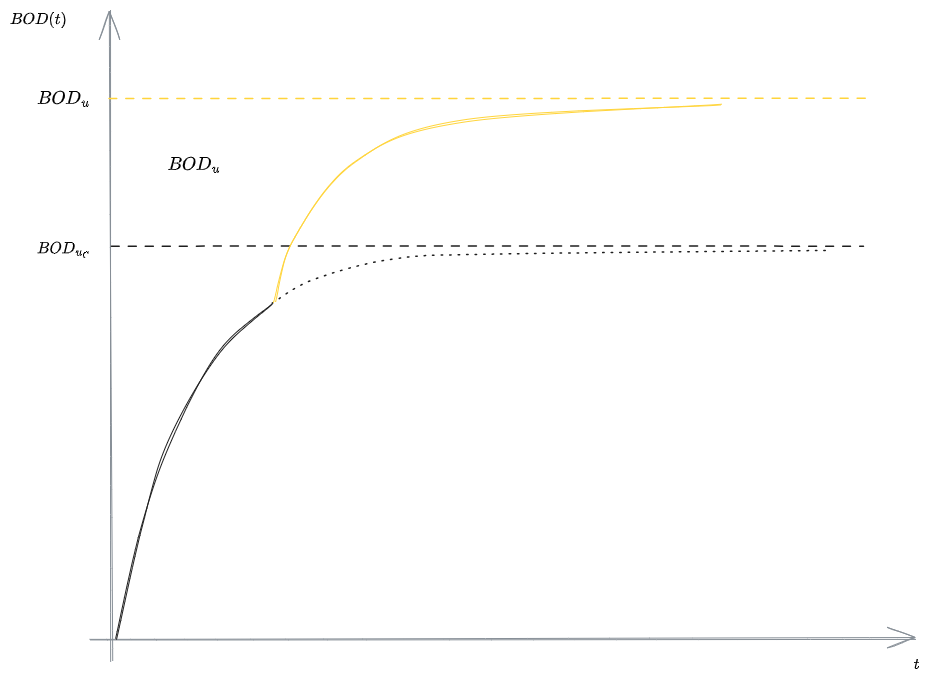
Gli organismi eterotrofi hanno cinetiche di crescita più rapide. Da un certo punto in poi otterremo una prevalenza di BOD dovuto al consumo di azoto.
❗❗❗❗❗❗❗❗❗❗❗❗❗
❗❗❗ COMPLETARE ❗❗❗ consumo di alcalinità, produzione di acidità, denitrificazione
❗❗❗❗❗❗❗❗❗❗❗❗❗
Nella reazione di #Nitrificazione finale c'è anche produzione di ioni
Alcalinità: capacità di un'acqua di neutralizzare un acido attraverso una base.
Produzione di acidità:=
Denitrificazione
La Denitrificazione è il processo di eliminazione dell'azoto dalle acque reflue. In particolare consiste nel rimuovere i nitrati, formatisi a seguito del processo di #Nitrificazione finale a partire dall'[[#Azoto ammoniacale]].
Processo di riduzione di nitrati da parte di microrganismi eterotrofi in condizioni anossiche (senza ossigeno) sono in grado di ossidare il substrato carbonioso organico.
Infatti in assenza di ossigeno questi organismi si procurano l'ossigeno da quello nei nitrati, producendo nitriti. Solitamente invece gli eterotrofi necessitano di ossigeno.
Liquame:
Altro:
Dovendo le condizioni di denitrificazione essere anossiche, non posso effettuare tale processo nello stesso reattore della [[#Nitrificazione finale]] avvenendo questa in condizioni aerobiche.
Fosforo
Il Fosforo è un macronutriente inquinante.
È essenziale ai fini della crescita delle specie viventi.
Il rapporto Carbonio:Azoto:Fosforo ottimale è
Il fosforo è ritenuto l'elemento principalmente responsabile dell'#Eutrofizzazione. L'eccesso di fosforo infatti incentiva la produzione di organismi acquatici. Si favoriscono così gli organismi che si procurano Carbonio e Azoto autonomamente e si ottiene di conseguenza una crescita algale abnormale.
Ci sono pertanto limitazioni sul contenuto di fosforo che può essere sverzato nell'ambiente.
Il Fosforo è presente in varie forme
- #Ortofosfati
- #Polifosfati
- #Fosforo organico
Ortofosfati
Sono solubili e derivano dalla scissione dei #Polifosfati.
Quella degli ortofosfati è la forma di #Fosforo più semplice da usare per gli organismi.
Polifosfati
Una forma di #Fosforo che ha ramificazione con il fosforo legato ad atomi di Idrogeno (H) e Ossigeno (O).
Fosforo organico
Il #Fosforo si trova legato a molecole organiche in varie forme che vengono scisse in composti elementari.