02. Cinetica delle reazioni chimiche
2. Cinetica delle reazioni chimiche
Ci occupiamo dello studio delle reazioni chimiche.
In particolare nell'Ingegneria sanitaria ambientale vogliamo studiare le reazioni chimiche per trasformare gli inquinanti.
Potremmo definire un reattore come un sistema di reazioni.
Guarderemo due aspetti:
- Termodinamico: Equilibrio termodinamico
- Cinetico: Per noi è importante sapere in quanto tempo si completa una reazione
Classificazione delle reazioni chimiche
Posso seguire diversi approcci per classificare le reazioni chimiche:
- #Classificazione per Natura dei componenti
- #Classificazione per Verso della reazione
- #Classificazione per Numero di stadi
- #Classificazione per Sequenza degli stadi
Classificazione per Natura dei componenti
In termini di natura dei componenti una reazione può essere classificata in:
Reazione omogenea
Una reazione si dice omogenea se tutte le specie si trovano nella stessa fase.
Reazione eterogenea
Una reazione si dice eterogenea se sono presenti specie in fasi diverse.
Interfaccia
Nel caso in cui si abbia una [[#Reazione eterogenea]], l'area di contatto tra le diverse fasi è detta interfaccia.
Classificazione per Verso della reazione
In termini di verso di reazione, si può avere:
Reazione Reversibile
Reazione Irreversibile
Nonostante la maggior parte delle reazioni nel nostro campo risulti reversibile, se ci si trova sufficientemente lontani dalle condizioni di equilibrio, e quindi la concentrazione dei prodotti risulta piccola, la #Velocità di reazione inversa sarà molto piccola rispetto a quella della reazione diretta. In questo caso parleremo di reazioni irreversibili
Classificazione per Numero di stadi
Stadio singolo
Stadi multipli
Classificazione per Sequenza degli stadi
Reazione con stadi in serie
❗❗❗❗❗❗❗❗❗❗❗❗❗
❗❗❗ COMPLETARE ❗❗❗
❗❗❗❗❗❗❗❗❗❗❗❗❗
Il passaggio da Reagenti a Prodotti avviene passando per fasi intermedie:
Reazione con stadi in parallelo
Si parla di reazioni con stadi in parallelo quando lo stesso reagente +è coinvolto in più di una reazione.
Velocità di reazione
Uno degli indicatori principali per descrivere una reazione è la velocità di reazione. Questa può essere vista come la massa (o il numero di moli) di reagente che scompare o del prodotto che appare, nell'unità di tempo.
Definisco la #Concentrazione Molare
Concentrazione Molare
Velocità di reazioni in reazioni omogenee
Posso pensare di usare la concentrazione al posto della massa:
Per cui si ha che:
e quindi:
La #Velocità di reazione sarà pertanto negativa in quanto il reagente si consuma e quindi la sua concentrazione diminuisce.
La velocità di reazione è alterata da:
- Concentrazione
- Condizioni termodinamiche (pressione, temperatura...)
- Presenza di catalizzatori o inibitori
Considerando un sistema ideale senza catalizzatori o inibitori, e a pressione atmosferica e temp cost.
Vediamo la formulazione analitica della relazione tra #Velocità di reazione e concentrazione
Si hanno 2 casi:
- #Cinetiche di ordine alpha
- #Cinetiche di saturazione
Cinetiche di ordine alpha
Dove:
#Ordine di reazione [[#Costante di velocità]]
Con
Nei casi comuni:
Noi faremo riferimento a valori di
Ordine di reazione
La costante
Costante di velocità
La costante
Ha unità di misura diverse a seconda dei valori di
Le unità di misura della costante di velocità dipende dall'[[#Ordine di reazione]]:
Cinetiche di saturazione
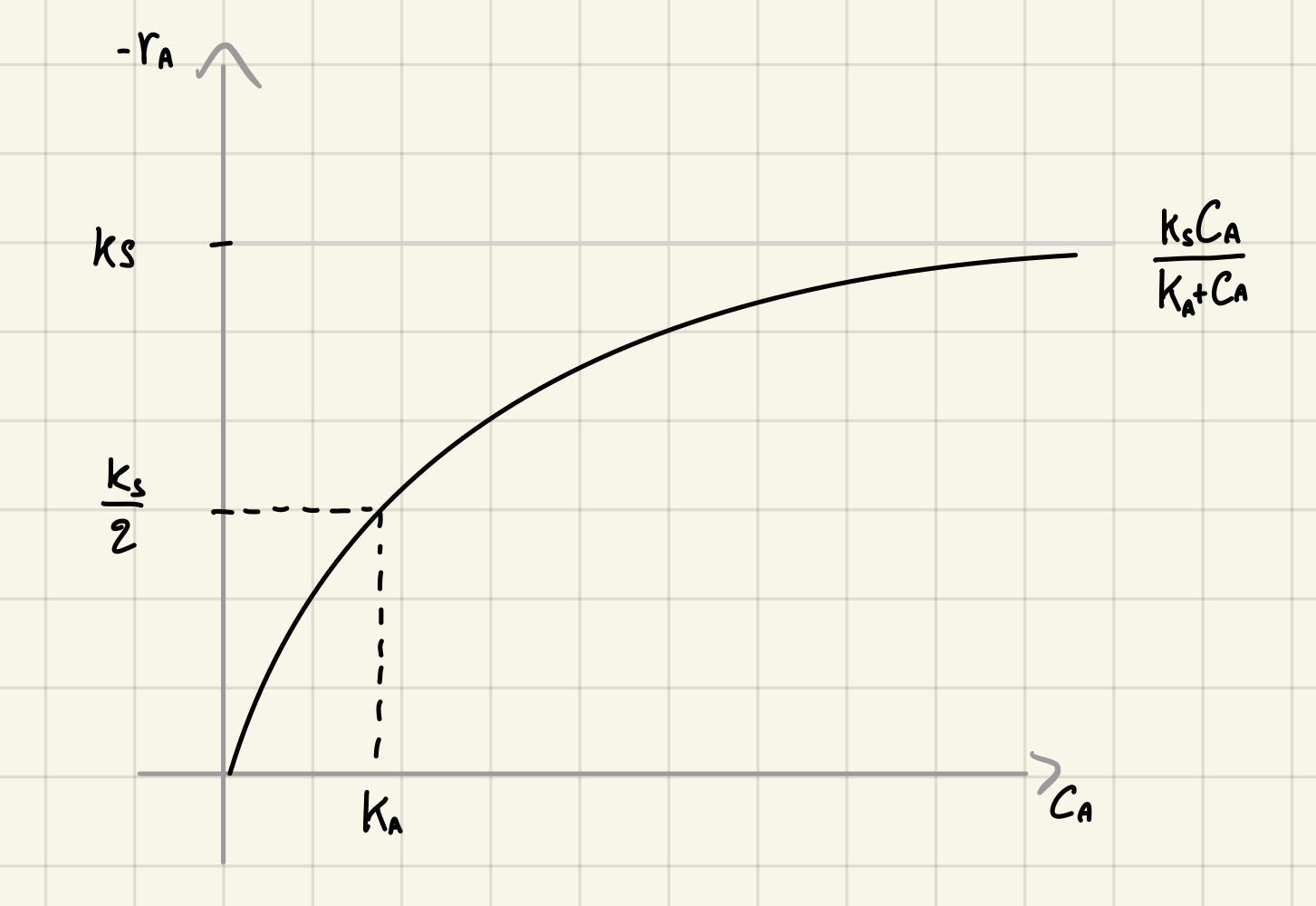
Dove:
Costante di velocità [[#Costante di semi-saturazione]]
Le cinetiche di saturazione hanno un andamento asintotico a un valore di velocità pari proprio alla [[#Costante di velocità]]
Nel caso delle cinetiche di saturazione è possibile semplificare la relazione funzionale attraverso delle opportune approssimazioni.
Dato
: Ricorda una Cinetica di ordine 0 : Ricorda una Cinetica di ordine 1
Durante una reazione, mi aspetto che la concentrazione di
Costante di velocità (saturazione)
<-- #Cinetiche di saturazione
La costante di velocità (
LA costante di velocità ha le dimensioni di una #Velocità di reazione:
Costante di semi-saturazione
<-- [[#Cinetiche di saturazione]]
La costante di semi-saturazione (o di mezza velocità) rappresenta la [[#Concentrazione Molare]] in corrispondenza della quale la [[#Velocità di reazione]] è pari alla metà del suo valore massimo (ossia la [[#Costante di velocità (saturazione)]])
La costante di semi-saturazione ha le dimensioni di una concentrazione:
Reattore di Batch
Il reattore di batch, detto anche reattore discontinuo ideale è
- Un reattore
- Discontinuo: dopo aver avviato la reazione procede tutto autonomamente
- Ideale: Le condizioni sono perfettamente omogenee (il composto è miscelato)
in cui inserisco il reagente tutto insieme, poi non faccio più nulla.
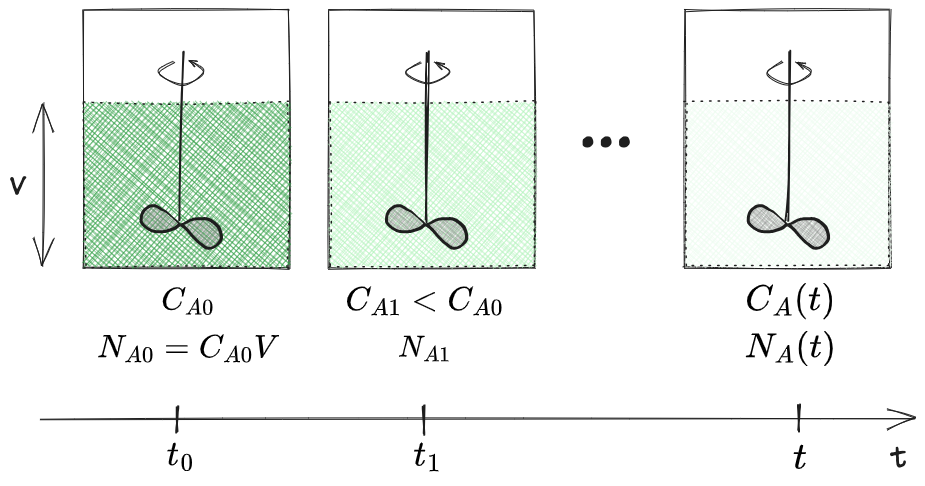
Principio di conservazione della massa
Ci sono due modi di descrivere il reattore:
- #Approccio integrale
- #Approccio differenziale
Approccio integrale
Vediamo le varie cinetiche con l'approccio integrale:
- #Cinetica di ordine 0 - integrale
- #Cinetica di ordine 1 - integrale
- #Cinetica di ordine 2 - integrale
- #Cinetica di saturazione - integrale
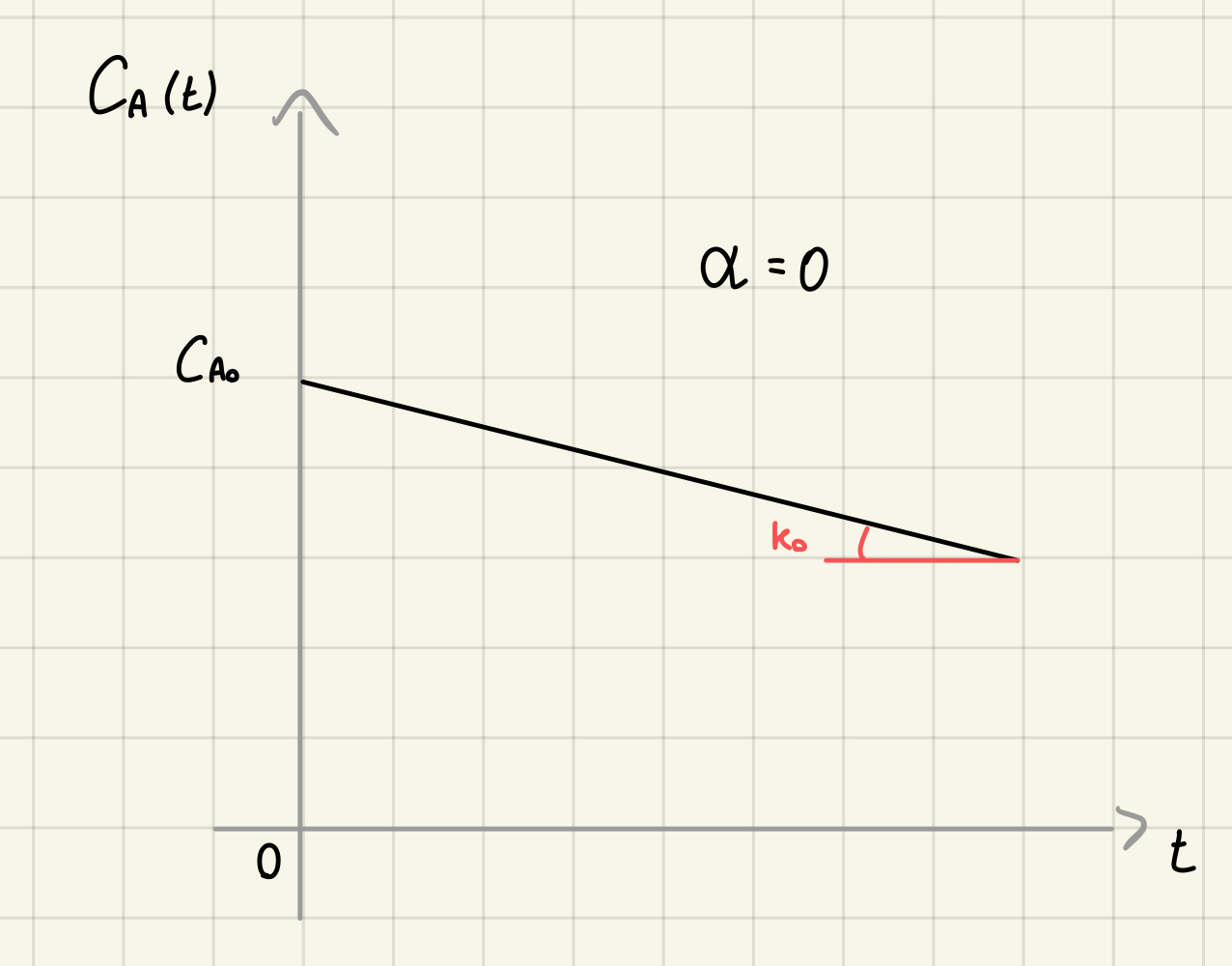
Cinetica di ordine 0 - integrale
Integro
Da cui ottengo:
Cinetica di ordine 1 - integrale
Integro
Da cui ottengo
e quindi:
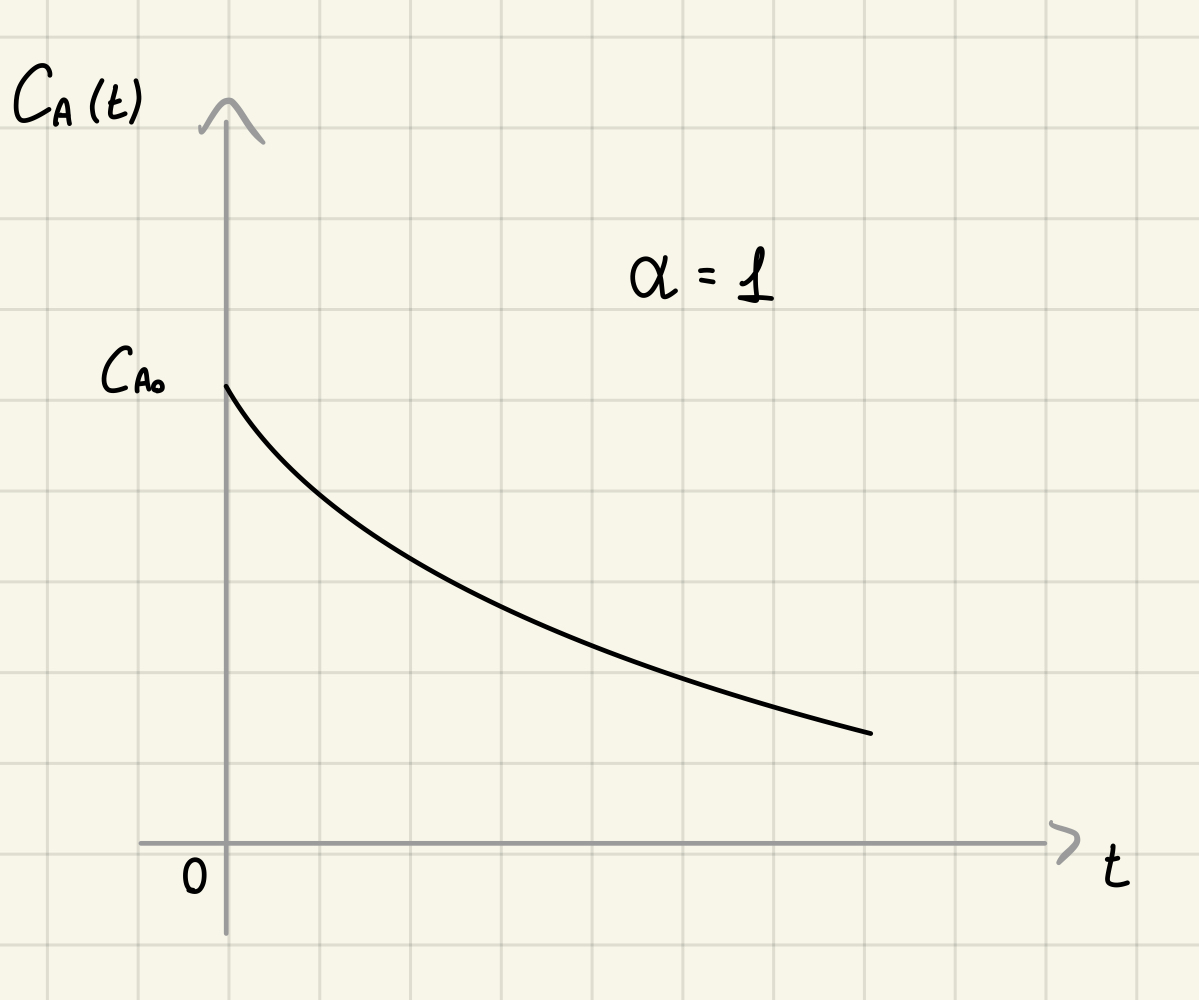
Come vedremo in seguito, conviene sempre tentare di linearizzare la relazione, graficandola su un piano diverso:
Cinetica di ordine 1 - linearizzazione
Applico il
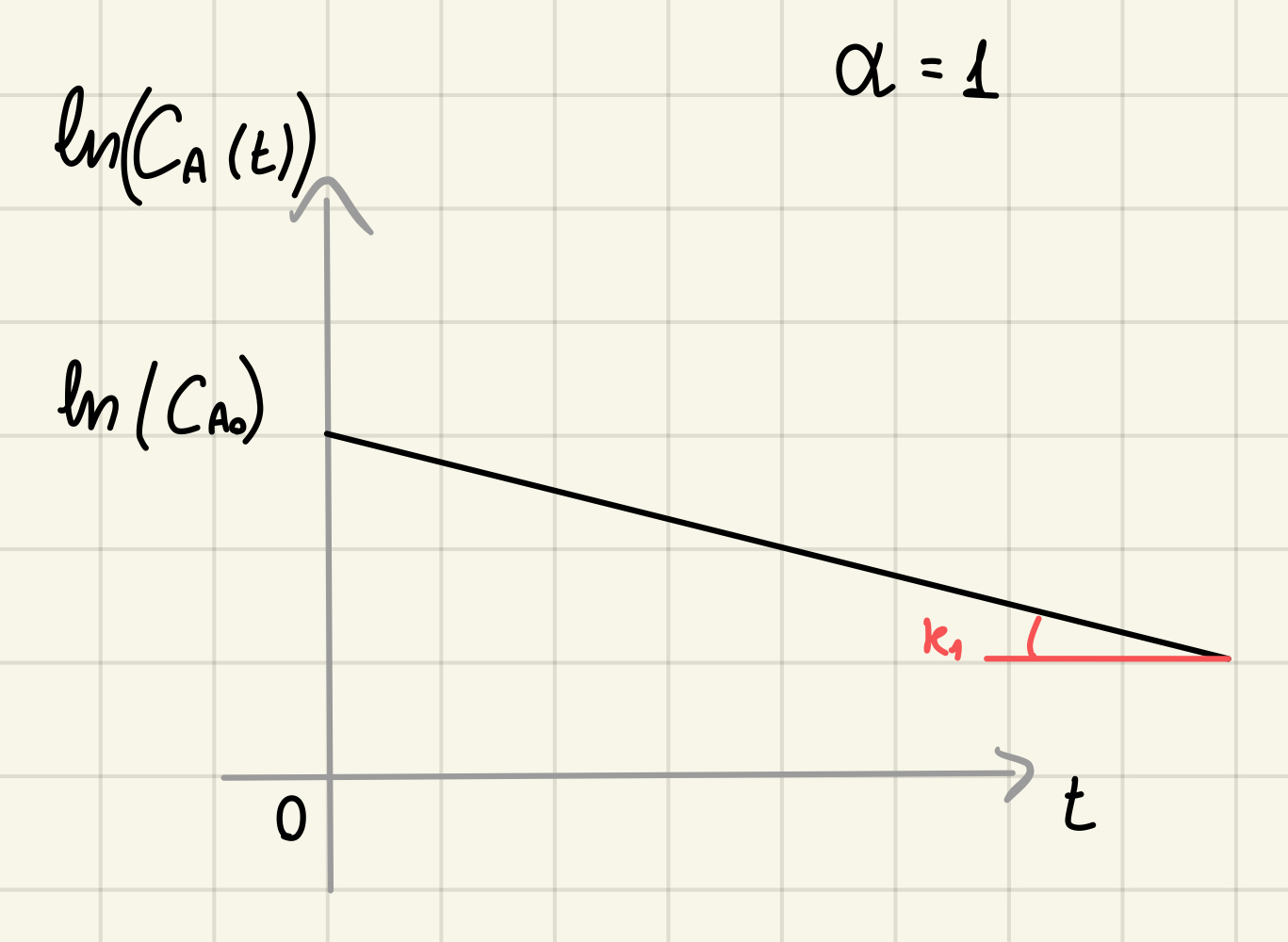
In questo modo abbiamo di nuovo una relazione in cui l'unico parametri è
Cinetica di ordine 2 - integrale
Integro
Da cui ottengo
che linearizzando diventa:
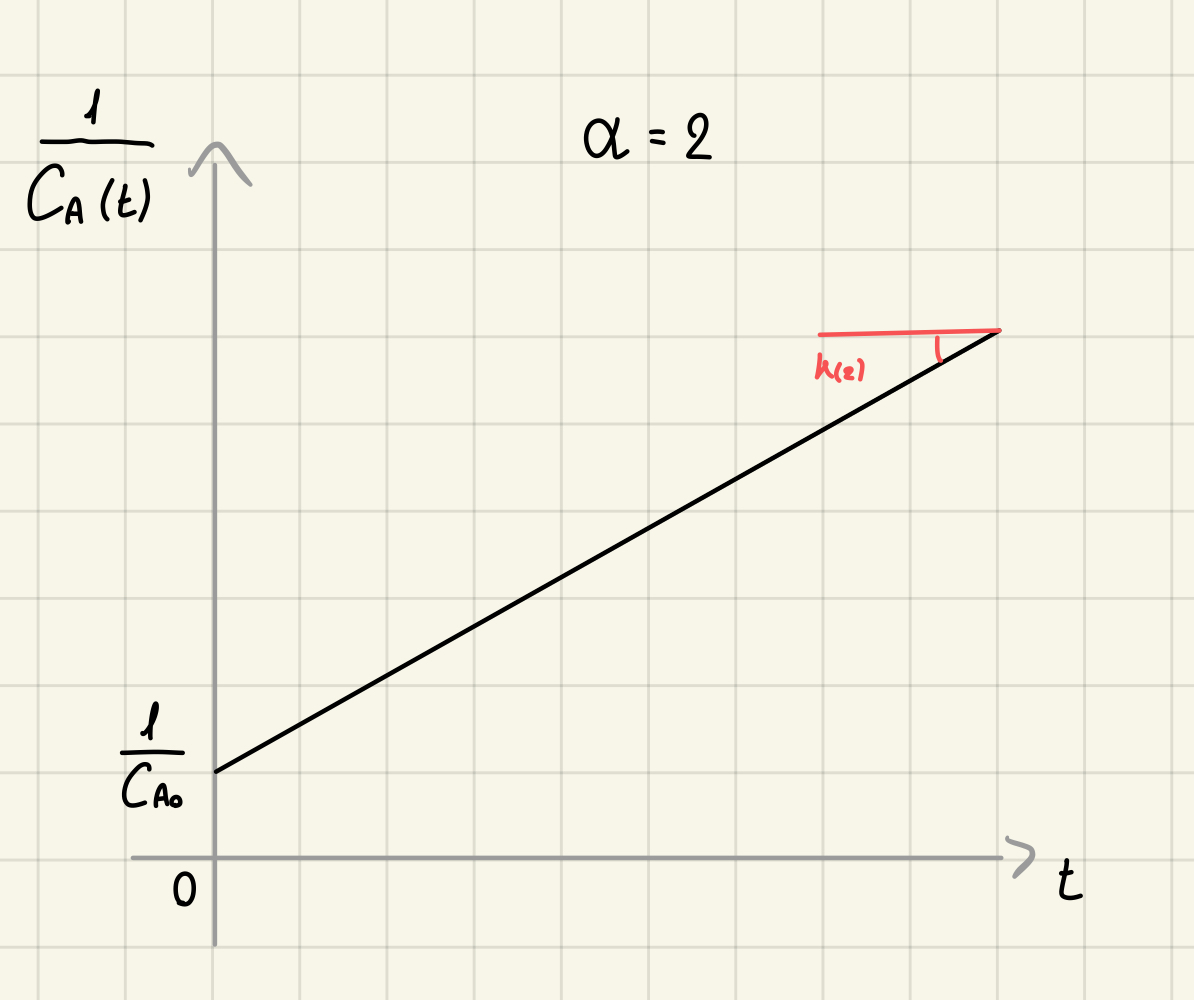
Cinetica di saturazione - integrale
Per le cinetiche di saturazione invece:
da cui ottengo, linearizzato:
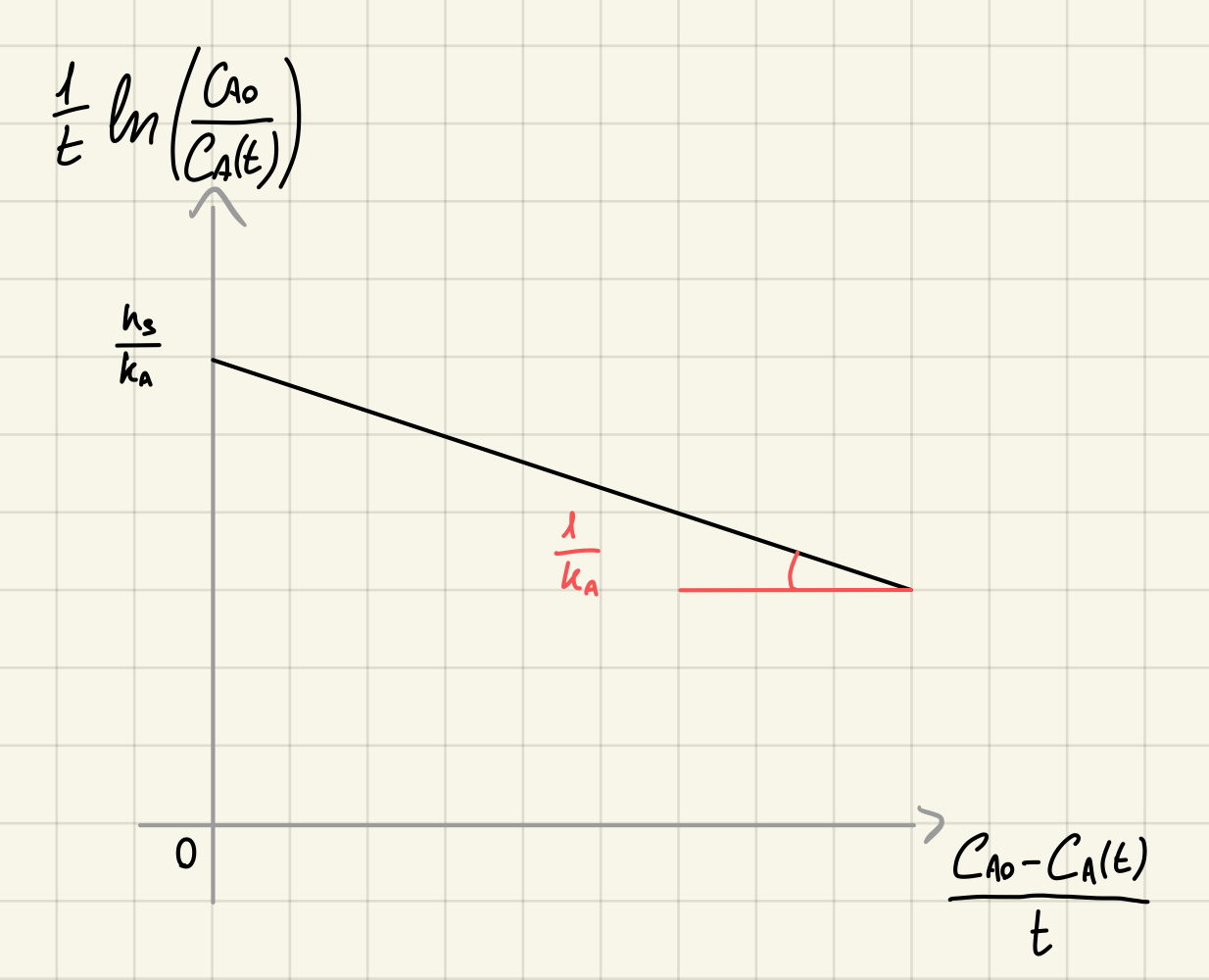
Confronto tra cinetiche linearizzate
Avere le cinetiche linearizzate, permette di confrontarle tutte graficamente.
A partire dai dati che si hanno a disposizione, si cerca su quale piano questi dati possono essere approssimati da una retta. A questo punto potremo associare al piano una delle 4 cinetiche capendo con che tipo di cinetica abbiamo a che fare.
Un'applicazione è mostrata e sviluppata in Es 1 - Determinazione dell'ordine di una reazione chimica - ISA.
Generalità sull'approssimazione
Per approssimare i dati si sfrutta la retta di regressione, un metodo di approssimazione ai minimi quadrati.
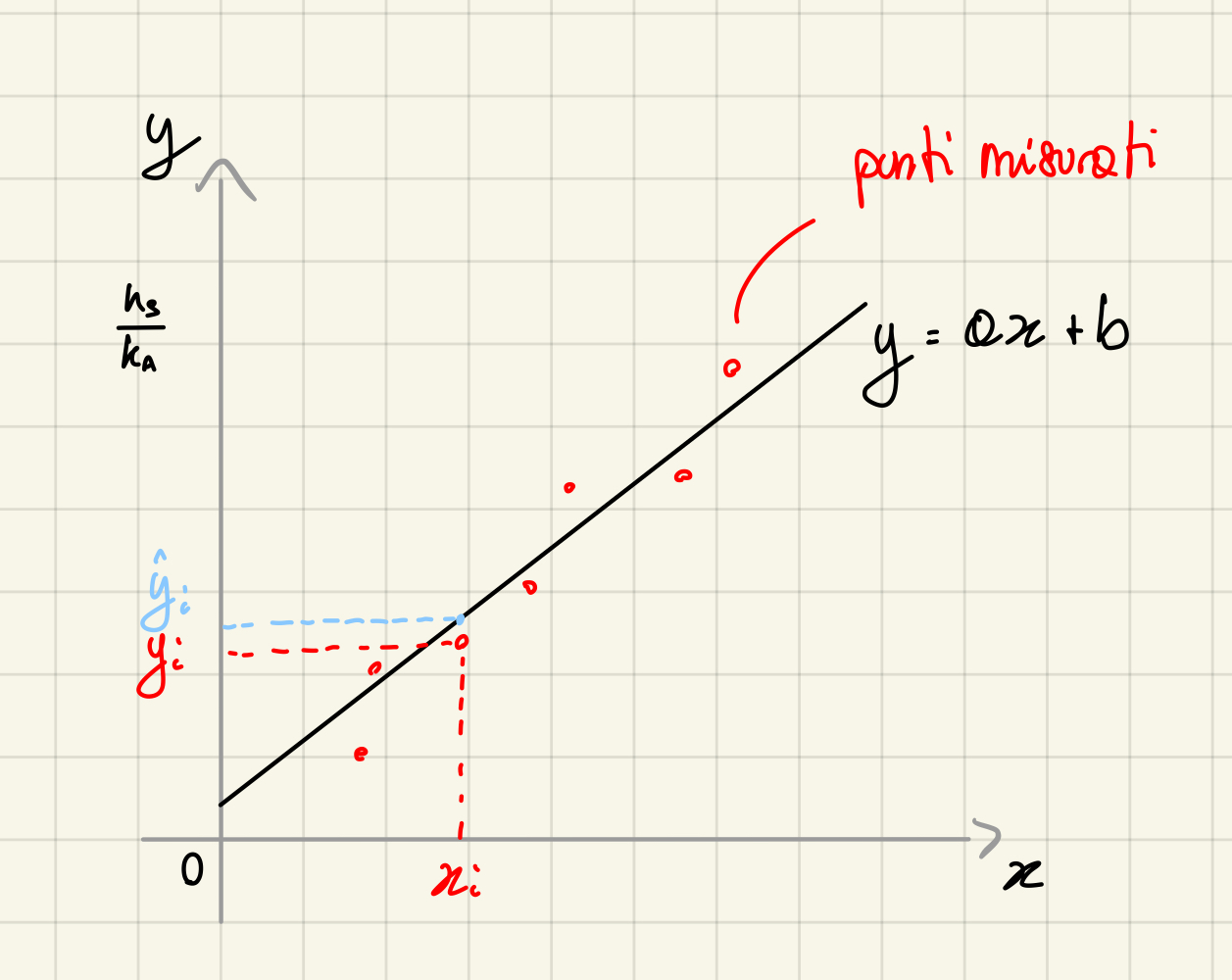
Coefficiente di determinazione
Ci chiediamo quanto la retta di regressione approssimi correttamente l'andamento reale dei dati. Possiamo definire quindi un numero, il coefficiente di determinazione
Si definisce come segue:
dove
con
Più
Approccio differenziale
Cinetiche di ordine alpha - differenziale
Che è già in una forma linearizzata.
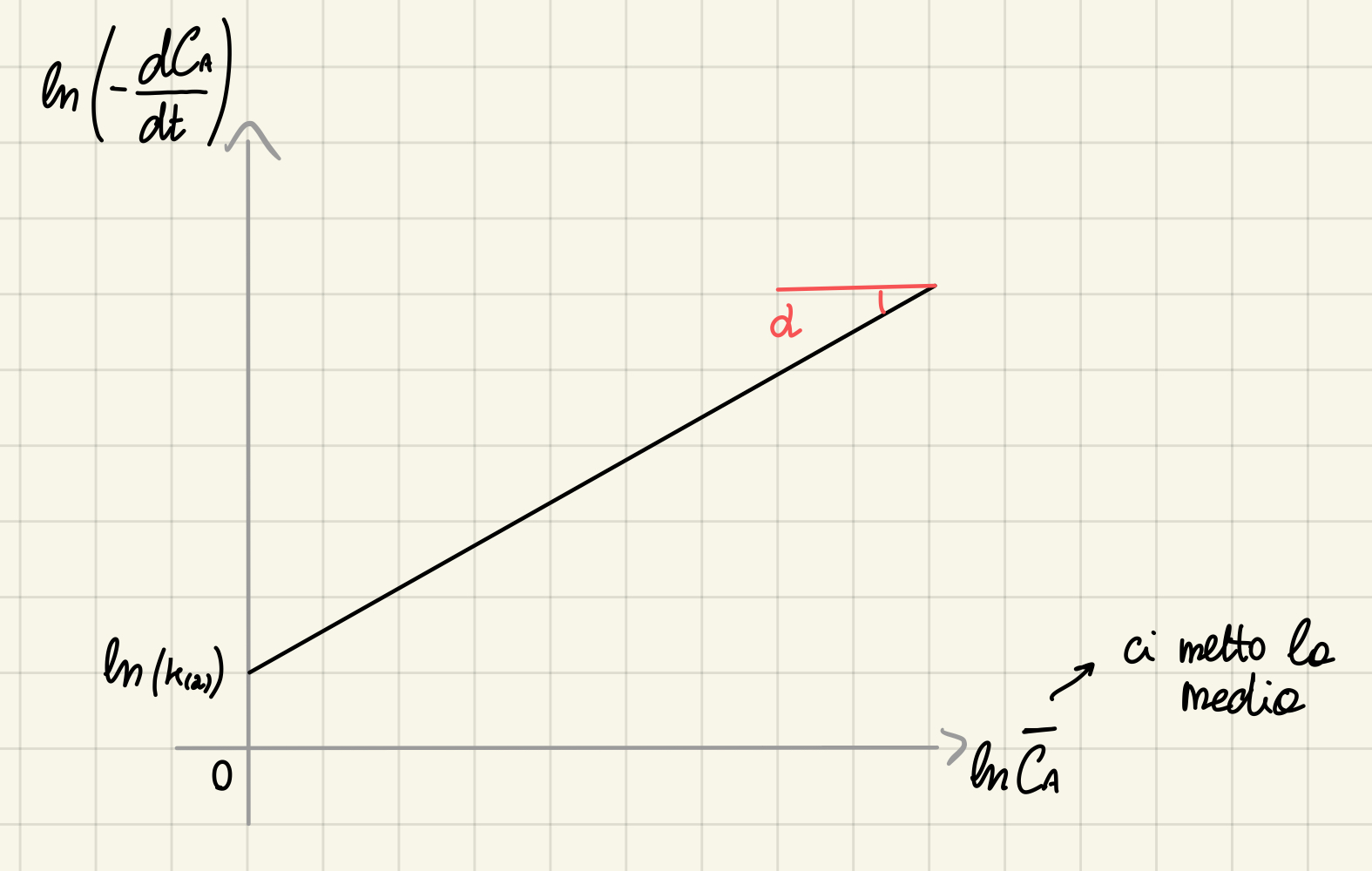
Siccome lavoro con un numero finito di punti discreti, non posso conoscere la derivata. Per questo motivo userò il rapporto incrementale:
e al posto di
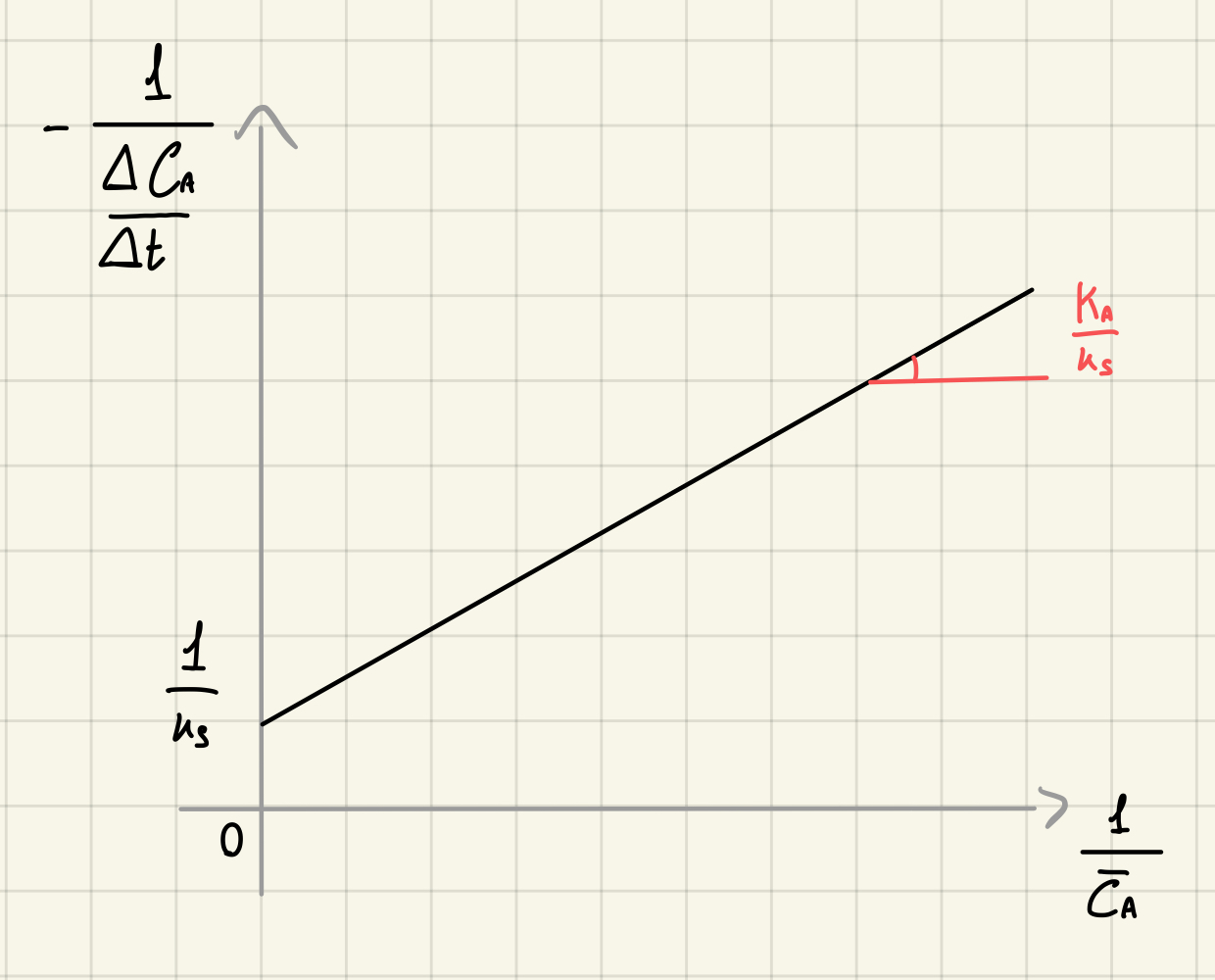
Cinetiche di saturazione - differenziale
A partire dalla relazione differenziale:
Posso linearizzare ottenendo:
Influenza della temperatura
Equazione di Vant'Hoff-Arrheius
La dipendenza della velocità di reazione dalla temperatura è data dall'equazione di Vant'Hoff-Arrheius:
dove:
Costante di velocità della generica reazione Temperatura Energia di attivazione caratteristica della reazione considerata Costante universale dei gas perfetti
Poiché la temperatura è variabile durante una reazione, devo integrare l'equazione di Arrheius per separazione di variabili
da cui otteniamo:
Consideriamo un campo di temperatura tale per cui possiamo considerare costante il prodotto
Si può riscrivere l'equazione come